Voľba čitateľa
Populárne články
úvod
Váš byt je zrekonštruovaný a je potrebné si kúpiť keramické obklady. V obchode, zatiaľ čo triedenie rôznych foriem a farieb na dlhú dobu, ste našli ten správny a ísť do pokladne, aby sa pohľad na tú časť balíka s dlaždice, kde bola napísaná jeho zloženie. Takmer všetky zložky sú známe, ale jedna z nich vás prekvapila - oxid kremičitý. Samozrejme, budete sa o ňom chcieť dozvedieť viac. Dnes sa budem snažiť uspokojiť váš záujem.
definícia
Kremík má premenlivú valenciu, a preto sú v chémii známe jeho dve zlúčeniny s kyslíkom. Dnes sa pozrieme na vyšší oxid kremičitý, v ktorom má valenciu IV.
názov
V rôznych zdrojoch sa môže nazývať oxid kremičitý, oxid kremičitý alebo oxid kremičitý.
vlastnosti
Je to kyslý oxid, ktorý je tvrdý a trvanlivý. Ak sa zahrieva a akýkoľvek alkalický / zásaditý oxid, budú vzájomne spolupôsobiť. Touto zlúčeninou kremíka je sklotvorná látka, to znamená, že môže viesť k podchladenému tavenému sklu.  Tiež (vo svojej čistej forme) neprechádza elektrickým prúdom (je dielektrické). Oxid kremičitý má atómovú kryštálovú mriežku. Je odolný voči kyselinám, ale výnimkou je fluorovodík a plynný fluorovodík. Reakčné produkty s nimi sú fluorid kremičitý a voda. Ak je druhým činidlom roztok fluorovodíka, potom jeho produkty budú kyselina hexafluórsiliková a rovnaká voda. Ak je kremík (IV) legovaný alkalickým / zásaditým oxidom / uhličitanom akéhokoľvek aktívneho kovu, reakčným produktom bude silikátová soľ kremičitanu, z ktorej sú rozpustné len kremičitany draselné a sodné. Produkty interakcie ktorejkoľvek z týchto látok s vodou sa nazývajú tekuté sklo. Majú silne alkalické prostredie, dôvodom je hydrolýza. Hydrolyzované kremičitany nie sú pravdivé, ale koloidné roztoky. Ak sa roztoky kremičitanov draselných alebo sodných kremičitanov mierne oxidujú, objaví sa želatínová biela zrazenina, ktorá sa skladá z hydratovanej kyseliny kremičitej.
Tiež (vo svojej čistej forme) neprechádza elektrickým prúdom (je dielektrické). Oxid kremičitý má atómovú kryštálovú mriežku. Je odolný voči kyselinám, ale výnimkou je fluorovodík a plynný fluorovodík. Reakčné produkty s nimi sú fluorid kremičitý a voda. Ak je druhým činidlom roztok fluorovodíka, potom jeho produkty budú kyselina hexafluórsiliková a rovnaká voda. Ak je kremík (IV) legovaný alkalickým / zásaditým oxidom / uhličitanom akéhokoľvek aktívneho kovu, reakčným produktom bude silikátová soľ kremičitanu, z ktorej sú rozpustné len kremičitany draselné a sodné. Produkty interakcie ktorejkoľvek z týchto látok s vodou sa nazývajú tekuté sklo. Majú silne alkalické prostredie, dôvodom je hydrolýza. Hydrolyzované kremičitany nie sú pravdivé, ale koloidné roztoky. Ak sa roztoky kremičitanov draselných alebo sodných kremičitanov mierne oxidujú, objaví sa želatínová biela zrazenina, ktorá sa skladá z hydratovanej kyseliny kremičitej.
recepcia
V priemysle sa oxid kremičitý získava zahrievaním kremíka v kyslíkovom prostredí. Oxiduje a vytvára požadovaný produkt. Tiež sa ťaží tepelnou oxidáciou. V laboratóriu sa oxid kremičitý získava pôsobením akýchkoľvek kyselín na rozpustný kremičitan, na to je vhodná aj slabá kyselina octová. Napríklad, ak ho skombinujete s kremičitanom sodným, reakčným produktom bude octan sodný a kyselina kremičitá. K jeho rozkladu dôjde okamžite a produkty jeho rozkladu budú voda a požadovaný oxid.
 prihláška
prihláška
Použitím oxidu kremičitého sa vyrába sklo, keramika, brúsivá, betónové výrobky a samotný kremík. Slúži tiež ako výplň v gumárenskom priemysle. Kryštály amorfnej modifikácie oxidu kremičitého - kremenného skla - majú piezoelektrické vlastnosti a tvorcovia rádiového inžinierstva, ultrazvukových systémov a zapaľovačov to používajú. Silikáty a kremičitany - takmer 90% hmotnosti litosféry. Oxid kremičitý je tiež známy ako potravinárska prísada E551. Je to jeho amorfná neporézna odroda. Zabraňuje spekaniu a zhlukovaniu potravín, vo farmaceutikách sa používa ako pomocná látka a enterosorbent. Filmy tohto oxidu slúžia ako izolátor pri výrobe mikročipov a iných elektronických komponentov. Taktiež vytvárajú optické káble. A vyhrievacie prvky elektronickej cigarety by boli nemožné bez vlákna oxidu kremičitého.
záver
Takto sa široko používa tento oxid. A vidieť to, nemusíte bežať do obchodu a zvedavosť, aby zvážila cement a betón. Prírodný oxid kremičitý je pod našimi nohami - to je obyčajný piesok. Ukazuje sa, že to môže byť užitočné.
Kremík. Štruktúra atómu, kryštalický kremík, jeho vlastnosti a aplikácie. Oxid kremičitý (IV), jeho prírodné odrody. Kremičitany. Hodnota zlúčenín kremíka v živej a neživej prírode. Koncepcia silikátového priemyslu.
téma: Kremík. Štruktúra atómu, kryštalický kremík, jeho vlastnosti a aplikácie. Oxid kremičitý (IV), jeho prírodné odrody. Kremičitany. Hodnota zlúčenín kremíka v živej a neživej prírode. Koncepcia silikátového priemyslu.
plán
1. Štruktúra atómu
2. Fyzikálne a chemické vlastnosti kremíka.
3. Získanie kyseliny kremičitej.
4. Silikáty. Stavebné materiály.
Referencie:
Silikón objavil a dostal v roku 1823 švédsky chemik Jens Jakob Berzelius. Druhý najčastejší prvok v zemskej kôre po kyslíku (27,6% hmotnosti). Nachádza sa v zlúčeninách.
Štruktúra atómu kremíka v základnom stave:
1s 2 2s 2 2p 6 3s 2 3p 2
Štruktúra atómu kremíka v excitovanom stave:
1s 2 2s 2 2p 6 3s 1 3p 3
kryštalický kremík - tmavo sivá látka s kovovým leskom, veľká tvrdosť, krehká, polovodičová; ρ = 2,33 g / cm3 , t ° pl. = 1415 ° C; t ° kip = 2680 ° C. Má štruktúru podobnú diamantu a vytvára silné kovalentné väzby. Je inertný.
Amorfný kremík- hnedý prášok, hygroskopická, kosoštvorcová štruktúra, ρ = 2 g / cm3 reaktívnejšie.
Získanie kremíka
V priemysle - vykurovanie uhlia pieskom:
2C + SiO 2 t˚ → Si + 2CO
V laboratóriu - zahrievanie piesku horčíkom :
2Mg + SiO 2 t˚ → Si + 2MgO
Chemické vlastnosti
Typické nekovové, inertné.
Ako redukčné činidlo:
Si 0 + O 2 t˚ → Si + 4 O 2
SiO + 2F2 → SiF4
Si 0 + C t˚ → Si +4 С
(SiC - karborundum - tuhé; používa sa na bodové brúsenie);
Silane (SiH4 ) sa získa rozkladom silicidov kovov kyselinou.
Mg2Si + 2H2S04 → SiH4 + 2MgSO4
3Si + 4HNO3 + 18HF → 3H2 + 4NO + 8H20
Ako oxidačné činidlo:
Si 0 + 2Mg t˚ → Mg2Si-4
Silicon Application:
Silikón je široko používaný v elektronike ako polovodič. Pridanie kremíka do zliatin zvyšuje ich odolnosť proti korózii. Silikáty, hlinitokremičitany a oxid kremičitý - hlavná surovina na výrobu skla a keramiky, ako aj pre stavebníctvo.
Silane - SiH4
Fyzikálne vlastnosti: Bezfarebný plyn, jedovatý, t ° pl. = -185 ° C, t ° kip. = -112 ° C
recepcia : Mg2Si + 4HCl -\u003e 2MgCl2 + SiH4
Chemické vlastnosti:
Oxid kremičitý (IV) - (SiO2) n
SiO 2 - kremeň, drahokam, ametyst
,
achát, jasper, opál
, oxid kremičitý (objem piesku). Kryštálová mriežka oxidu kremičitého (IV) je atómová a má nasledujúcu štruktúru: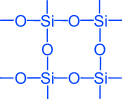

A12032Si02 2H2 O - kaolinit (hlavná časť ílu)
K20 Al2036Si02 - ortoclasa (živca)
Fyzikálne vlastnosti:Pevná kryštalická žiaruvzdorná látka, t ° pl = 1728 ° C, t ° kip = 2590 ° C
Chemické vlastnosti:
Oxid kyseliny. Pri spájaní so základnými oxidmi, zásadami a uhličitanmi alkalických kovov a kovov alkalických zemín.
SiO2 + CaO t ° → CaSiO3
Si02 + 2NaOH t ° → Na2Si03 + H20
Si02 + CaCO 3 t˚ → CaSiO3 + C02
Si02 + K2CO 3 t˚ → K2Si03 + C02
Si02 + 4HF t˚ → SiF4 + 2H20
SiO2 + 6HF t˚ → H2 (kyselina hexafluórkremičitá) + 2H20)
(reakcie sú základom procesu leptania skla).
použitie:
2. Získanie kyseliny kremičitej.
x Si02 yH20 
x = 1, y = 1 H2Si03 - kyselina metakremičitá
x = 1, y = 2H4SiO4 - kyselina ortokremičitá atď.
Fyzikálne vlastnosti: H2Si03 - veľmi slabá (slabšia ako uhlie), krehká, mierne rozpustná vo vode (tvorí koloidný roztok), nemá kyslú chuť.
príjem:
Vplyv silných kyselín na silikáty - Na2 SiO3 + 2HCl → 2NaCl + H2Si03 ↓
(získanie silikagélu, získanie kyseliny kremičitej)
Chemické vlastnosti:
Soli kyseliny kremičitej sa nazývajú -kremičitany.
Na2S03 + H20 + C02 = Na2C03 + H2Si03
Na2Si03 + CaCl2 = 2NaCl + CaSi03 ↓
(K20Al2036Si02) (živec) + CO2 + 2H20 → (Al2O3 2SiO2 2H2 0) (kaolinit (ílu)) + 4SiO2 (oxid kremičitý (piesok)) + K2 C03
Do skúmavky s roztokom kremičitanu draselného sa pridá roztok kyseliny chlorovodíkovej zriedenej. Biela polotuhá hmota vytvorená in vitro - kyselina kremičitá.
Na2S03 + HCI = 2NaCl + H2Si03 
Použitie zlúčenín kremíka
Prírodné zlúčeniny kremíka - piesok (SiO2 ) a silikáty sa používajú na výrobu keramiky, skla a cementu.
Zloženie obyčajného okenného skla je približne vyjadrené vzorcom Na2O CaO6SIO2 , Sklo sa vyrába tavením zmesi sodnej sódy v špeciálnych peciach.2 C03 vápenec3 a biely piesok SIO2.
3. Silikáty. Stavebné materiály.

keramika |
|
porcelán = kaolín + íl + kremeň + živec. Vlasti porcelánu - Čína, kde je porcelán známy už v 220g. V roku 1746 vznikla v Rusku výroba porcelánu
| Fajáns - z mena talianskeho mesta Faenza. Kde sa v 14. a 15. storočí vyvinulo keramické remeslo. Fajáns - líši sa od porcelánu s vysokým obsahom ílu (85%), nižšej teploty vypaľovania.
|
Sklo je krehký, priehľadný materiál, ktorý je schopný zmäkčiť a pri vytvrdnutí má akýkoľvek tvar. Sklo sa vyrába varením náboj (surová zmes pozostávajúca z piesku, sódy a vápenca) v špeciálnych peciach na tavenie skla.


Hlavné reakcie vyskytujúce sa počas tavenia vsádzky
1. Na2C03 + Si02 = Na2Si03 + C02
2. CaC03 + Si02 = CaSi03 + C02
3. Na2Si02 + CaSiO3 + 4Si02 = Na20 * CaO * 6Si02 - okenné sklo
R silikáty2 O nSi02, deR2 O - oxidy sodíka alebo draslíka sa nazývajú rozpustné sklo a ich koncentrované roztoky - tekuté sklo.
Často sa pri výrobe skla soda nahrádza sulfátom sodným a uhlím. V tomto prípade sa pomocou reakčnej rovnice vytvorí kremičitan sodný:
Keď sa pridá oxid olovnatý, získa sa kryštál. Na výrobu špeciálneho skla sa mení zloženie východiskovej zmesi. Nahradenie Na Soda2 CO 3 budeme potaš K2C03 , dostať žiaruvzdorné sklo (pre chemické sklo). Prísady oxidov kovov do výstupnej zmesi dávajú sklu inú farbu: oxid chrómu - (III) Cr2 o 3 , - zelený, oxid kobaltu (II) CoO - modrý, oxid manganičitý MpO2 - červená - fialová.
cement 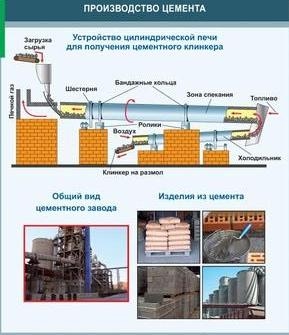

Pravidelný silikátový cement je zelenošedý prášok, ktorý po zmiešaní s vodou stvrdne vo vzduchu (alebo vo vode) a mení sa na kamennú hmotu. Zvyčajne sa získava kalcináciou (1400 - 1600 ° C) na spekanie surovej zmesi, ktorá sa skladá z vápenca a ílu. Kalcinácia sa vykonáva v špeciálnych valcových reverzných peciach.slinku - guľôčky tmavosivej farby sa získavajú spekaním hlinky a vápenca v špeciálnych rotačných peciach. Upravením zloženia zmesi sa získa rôznych typov cement - rýchlo vytvrdzujúci, mrazuvzdorný, odolný voči korózii. Zo zmesi cementu, vody a plnív (piesok, štrk, drvený kameň, troska) sa po vytvrdnutí získa umelý kameň - betón. Zmes týchto materiálov na tuhnutie sa nazýva betónová zmes. Po vytvrdnutí sa cementová pasta viaže na zrno plniva. K vytvrdnutiu dochádza aj vo vode. Betón s oceľovou výstužou (vnútorný rám) sa nazýva železobetón.
Úlohy pri určovaní:
Si → SiO 2 → Na 2SiO 3 → H 2 SiO 3 → SiO 2
domácu úlohu
Literatúra 3.
Práca na §30-33
Kremík. Silán, silicidy, oxid kremičitý (IV). Kyseliny kremičité, silikáty
8.1. Kremík. Silán, silicidy
Kremík je analógom uhlíka, ale jeho nekovové vlastnosti sú menej výrazné ako vlastnosti uhlíka.
Pre kremík je hybridný stav sp3 charakteristickejší, preto môže kremík vykazovať oxidačné stavy 4 a -4 v zlúčeninách.
Kremík - najbežnejší prvok po kyslíku na Zemi. Hmotnostný podiel kremíka v zemskej kôre je 27,6%. V prírode je kremík distribuovaný vo forme oxidu kremičitého, tiež nazývaného oxid kremičitý, ktorý sa nachádza vo forme piesku, kremeňa. Ďalšou skupinou prírodných zlúčenín kremíka sú silikáty - deriváty kyseliny kremičitej. Najčastejšie hlinitokremičitany, ktoré zahŕňajú živce (albit) NaAlSi 3 O 8, živca (ortoclasa) KAlSi 3 O 8\u003e íl (kaolín) Al 2 O 3 2SiO 2 2H 2 O, nefelín Na 3 K 4 atď. tvoria škrupinu zemskej kôry. Zlúčeniny kremíka sa nachádzajú v rastlinách a zvieratách.
recepcia
V priemysle sa kremík vyrába redukciou SiO 2 koksom v elektrických peciach:
Si02zC = S2CO
V laboratóriu ako redukčné činidlo s použitím horčíka alebo hliníka:
Si02 2Mg = Si 2MgO 3SiO2 4Al = 3Si2Al2O2
Najčistejší kremík sa získa redukciou tetrachlórmetánu vodíkom pri 1200 ° C: SiCl4 2H2 = Si 4HCl
^ Fyzikálne vlastnosti
Kryštalický kremík je tmavosivá látka s oceľovým leskom. Štruktúra kremíka je podobná štruktúre diamantu. Vo svojom kryštáli je každý atóm obklopený štvorstennými štyrmi ďalšími a je s nimi spojený kovalentnou väzbou, ktorá je oveľa slabšia ako medzi atómami uhlíka v diamante.
V kremíkovom kryštáli, aj za normálnych podmienok, sú niektoré kovalentné väzby zničené. Preto obsahuje voľné elektróny, ktoré spôsobujú nízku elektrickú vodivosť. Keď osvetlenie a kúrenie zvyšuje počet rozbitých väzieb, čo znamená, že sa zvyšuje počet voľných elektrónov a elektrická vodivosť sa zvyšuje. Tak by sa mali vysvetliť polovodičové vlastnosti kremíka. Kremík je veľmi krehký, jeho hustota je 2,33 g / cm3. Ako uhlie, aj kremík je žiaruvzdorná látka.
Kremík pozostáva z troch stabilných izotopov: 28 14 Si (92,27%),
29 14 Si (4,68%) a 30 14 Si (3,05%).
^ Chemické vlastnosti
na chemických vlastností Kremík, podobne ako uhlík, je nekovový, ale jeho nemetalicita je od tej doby menej výrazná má väčší atómový polomer. Pretože atómy kremíka majú 4 elektróny na vonkajšej úrovni energie, oxidačný stav oboch -4 a 4 je typický pre kremík.
Kremík za normálnych podmienok je skôr inertný, čo je vysvetlené silou jeho kryštálovej mriežky. Priamo interaguje iba s fluórom:
Si2F2 = SiF4
Rozdrvený kremík pri zahriatí kyslíkom na oxid kremičitý (IV):
Si02 = Si02
Kremík reaguje s chlórom pri 400-600 ° С:
Si2C12 = SiCl4
Kedy veľmi vysoké teploty kremík je schopný priamo kombinovať s uhlíkom a dusíkom:
3Si2N2 = Si3N4
Karbid kremíka SiC (karborundum) má kryštálovú mriežku podobnú diamantu, v ktorej je každý atóm kremíka obklopený štyrmi atómami uhlíka a naopak, kovalentné väzby sú veľmi silné, ako v prípade diamantu. Preto je veľmi tvrdý
K diamantu. Brúsne kamene a brúsne kotúče sú vyrobené z karbidu kremíka.
Kyseliny (iné ako zmes fluorovodíka HF a dusičnanu HNO 3) neovplyvňujú kremík. Rozpúšťa sa však v alkáliách, vytvára silikát a vodík:
Si2NaOHH20 = Na2Si03H2
Kremík s niektorými kovmi - Sn, Al, Zn, Pb, Au, Ag - nereaguje chemicky. S inými kovmi, napríklad s Mg, Ca, Cu, Fe, Pt, Bi, reaguje s tvorbou silicidov:
2Sa Si = Ca2Si
V závislosti od štruktúry a vlastností môžu byť silicidy rozdelené do dvoch skupín. Prvý zahŕňa silicidy alkalických kovov a kovov alkalických zemín (Li4Si, Ca2Si). Rozkladajú sa vodou a zriedenými kyselinami s uvoľňovaním silánov:
Ca2Si4HCl = 2CaCl2SiH4
Najzaujímavejšia skupina kovových silicidov tvorených prechodnými kovmi. V štruktúre týchto silicidov sú reťazce a vrstvy atómov kremíka umiestnené v kryštalickej mriežke kovu. Jedná sa o pevné látky s pomerne vysokými bodmi topenia. Je veľmi dôležité, aby silicidy neoxidovali ani pri vysokých teplotách. Silicid molybdénu MoSi 2 sa teda nemení na vzduchu do 1600 ° C, čo umožňuje jeho použitie ako ohrievača pre elektrické pece.
Tvorba silicidových vrstiev na kovoch je široko používaná na ochranu pred oxidáciou a koróziou v rôznych chemických činidlách. Mnohé silicidy sú polovodiče.
SiH4 silán, uvoľňovaný kyselinou chlorovodíkovou na silicide, je jedovatý plyn s nepríjemný zápach, Vzťahuje sa na skupinu hydridov kremíka - zlúčeniny kremíka s vodíkom. Molekuly vodíka kremíka sú podobné štruktúre ako uhľovodíky. Pri izbovej teplote sú monosilánom SiH4 a disilanom Si2H6 plynné látky a zvyšné silány, na posledný známy Si8H18, sú prchavé kvapaliny. Sú jedovaté a majú nepríjemný zápach, Chemicky menej odolné ako uhľovodíky.
Silane sa samovznietia na vzduchu:
SiH202 = Si02 2H20
Voda rozloží silány:
Si2H64H20 = 2Si02, 7H2
Tvorba a ďalší rozklad SiH4 sa používa na získanie čistého kremíka v polovodičovom priemysle.
prihláška
Ako polovodič sa používa kremík. Z neho sa vyrábajú takzvané solárne batérie, ktoré premieňajú svetelnú energiu na elektrickú energiu (napájanie rádiových zariadení kozmickej lode). Kremík sa používa v metalurgii na výrobu kremíkových ocelí s vysokou tepelnou odolnosťou a odolnosťou voči kyselinám.
^ 8.2. Oxid kremičitý (IV)
Oxid kremičitý (IV) (oxid kremičitý) je najbežnejšou zlúčeninou v kôre, ktorá obsahuje 12% svojej hmotnosti vo forme rôznych minerálov. Rozlišujte kryštalický a amorfný oxid kremičitý.
1) ^ Kryštalický oxid kremičitý - vo forme minerálu kremeňa a jeho odrôd (skalný kryštál, chalcedón, achát, jasper, pazúrik); kremeň tvorí základ kremenných pieskov široko používaných v stavebníctve av silikátovom priemysle.
2) ^ Amorfný oxid kremičitý - vo forme opálového minerálneho zloženia Si02 nH20; zemité formy amorfného oxidu kremičitého sú diatomit, tripoli (infusorial earth); Príkladom umelého amorfného bezvodého oxidu kremičitého je silikagél, ktorý sa získava z metakremičitanu sodného:
Silikagél má vyvinutý povrch, preto dobre absorbuje vlhkosť.
kremeň- veľmi tvrdá, trvanlivá, žiaruvzdorná látka, teplota topenia 1723 ° C. Po rýchlom ochladení roztavenej hmoty sa vytvorí kremenné sklo. Z neho sa vyrába laboratórne sklo a nástroje na vedecký výskum.
Najjednoduchší vzorec oxidu kremičitého (IV) je Si02. Kryštalizuje v atómovej mriežke. Štruktúra Si02 v rovinnom obraze môže byť znázornená nasledovne:

Každý atóm kremíka je uzavretý v tetraedróne 4 atómov kyslíka. V tomto prípade sa atóm kremíka nachádza v strede a atómy kyslíka sa nachádzajú na vrcholoch štvorstenu. Celý kus oxidu kremičitého možno považovať za kryštál, ktorého vzorec je (Si02) n. Takáto štruktúra oxidu kremičitého (IV) spôsobuje jeho vysokú tvrdosť a žiaruvzdornosť.
Chemické vlastnosti
Vo vode je Si02 prakticky nerozpustný. Ako oxid kyseliny reaguje, keď je kondenzovaný s pevnými zásadami, zásaditými oxidmi a uhličitanmi, za vzniku solí kyseliny kremičitej:
Si02 2NaOH = Na2Si03H20
Si02C03 = CaSi03
Si02Na2C03 = Na2Si03C02
Kyseliny nepôsobia na Si02. Postupne sa rozpúšťa iba kyselina fluorovodíková:
Si02 4HF = SiF4 2H20
Táto reakcia je základom leptania skla. Žiarenie zmesi Si02 s uhlíkom do 2000 ° C vedie k tvorbe karbidu kremíka SiC, nazývaného karborundum: SiO 2 2C = SiC 2CO
prihláška
Oxid kremičitý (IV) je široko používaný v silikátovom priemysle pri výrobe skla, keramiky, betónových výrobkov, silikátových tehál. Čistý kremeň je nevyhnutný pri výrobe nástrojov. Kryštálové kryštály sú piezoelektrické - môžu takmer bez straty premieňať elektrickú energiu na mechanickú energiu. Z malých kryštálov kremeňa a z výrobných odpadov piezoelektrických dosiek sa získa kremeň
Tabuľka 26.
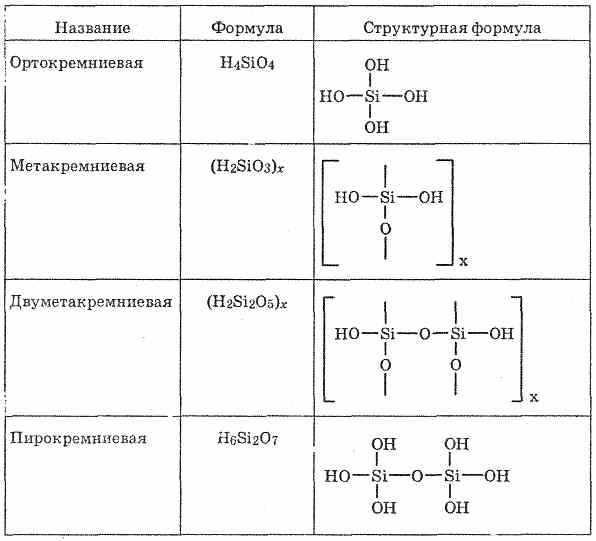
Kyselina kremičitá
Glass. Je transparentný nielen pre viditeľné svetlo, ale aj pre ultrafialové žiarenie, ktoré má liečivý účinok.
^ 8.3. Kyseliny kremičité, silikáty
Kyseliny kremičité - zlúčeniny oxidu kremičitého (IV) s vodou, veľmi slabé kyseliny. Pomer Si02 a H20 v kyselinách kremičitých je veľmi odlišný, preto je ich zloženie zvyčajne reprezentované ako všeobecný vzorec "Si02 mH20. n ľahko sa navzájom premieňajú. Vo voľnom stave sa izolovala kyselina ortokremičitá H4Si04, methacilaminový H2Si03 a niekoľko ďalších kyselín (pozri tabuľku 26).
Kyselina kremičitá sa získava nepriamo pôsobením. kyselina na kremičitane draselnom alebo sodnom: \\ t
Na2Si03HCl = 2NaClH2Si03
Kyselina kremičitá nemôže byť získaná v čistej forme. Vo vodných roztokoch tvorí koloidný roztok alebo sol, ktorý existuje veľmi krátku dobu. Sol ďalej koaguluje a vytvára sa gél. Keď sa gél vysuší, vytvoria sa produkty s poréznou štruktúrou - silikagélové gély používané ako sušidlá a adsorbenty.
H 2 SiO 3 - kyselina je veľmi slabá, mierne rozpustná vo vode. Pri zahriatí sa ľahko rozkladá ako kyselina uhličitá:
H2Si03 = H20Si02
Ako kyselina dvojsýtna sa dištancuje v krokoch:
H 2 SiO 3-H HSiO - 3
HSiO-3'H SiO 2-3
Kyselina kremičitá je slabšia ako uhlie.
Vo vodných roztokoch kyselina uhličitá vytesňuje kremičitan z ich solí:
Na2Si03H20C02 = Na2C03H2Si03
Soli kyseliny kremičitej sa nazývajú silikáty. Ich zloženie je zvyčajne reprezentované vzorcom vo forme zlúčenín oxidov prvkov. Napríklad kremičitan vápenatý CaSi03 môže byť vyjadrený ako: CaO Si02.
Silikáty sú zvyčajne nerozpustné vo vode. Výnimkou sú kremičitany sodíka a draslíka, získané tavením Si02 s príslušnými hydroxidmi alebo uhličitanmi, napríklad:
Si02Na2C03 = C02Na2Si03
Vodné roztoky týchto solí sa nazývajú "kvapalné sklo". V dôsledku hydrolýzy má "kvapalné sklo" silne alkalickú reakciu. " Tekuté sklo"Používa sa ako spojivo pri výrobe betónov odolných voči kyselinám, ako aj pri výrobe tmelu, kancelárskeho lepidla." Sú impregnované tkaninou, drevom a papierom, aby poskytli požiarnu odolnosť a vodotesnosť.
Zemská kôra pozostáva z oxidu kremičitého (IV) a rôznych kremičitanov. Prírodné silikáty majú komplexné zloženie a štruktúru. Napríklad:
Živec K 2 O Al 2 O 3 6 SiO 2 mica K 2 O 3 Al 2 O 3 6 Si 2 2 2 2 azbest 3MgO 2SiO 2 2H 2 O kaolín Al 2 O 3 2SiO 2 2H 2 O
Kremičitany obsahujúce oxid hlinitý sa nazývajú aluminosilikáty. V prírode sú najčastejšie, ako napríklad živce, ako aj zmesi rôznych druhov
Nykh silikáty. Skaly - žuly a ruly - pozostávajú z kremenných kryštálov, živca a sľudy.
Horniny a minerály na povrchu zeme pod vplyvom teploty a potom oxidu uhličitého miznú, t. pomaly sa zrúti.
K20 Al2O3Si02 2H20C02 Al203 2Si02 2H20 K2C03 4Si02
Hlavným produktom deštrukcie je minerál kaolinitu - hlavná zložka bielej hliny. V dôsledku zvetrávania hornín sa vytvorili usadeniny ílu, piesku a solí.
Vlastnosti kremičitanov sú celkom odlišné v závislosti od ich zloženia a štruktúry. Silikáty často tvoria transparentné a veľmi krásne farebné kryštály; niektoré z nich sú drahé kamene používané v šperkoch (granát, topaz, smaragd, atď.). Hustota kremičitanov je zvyčajne v rozsahu od 2 do 4 g / cm3. Tvrdosť je niekedy veľmi malá (napríklad mastenec), ale je dosť významná (napríklad zirkón ZrSiO 4). Keď sa zahrejú silikáty, buď sa topia alebo sa rozkladajú v pevnom stave. Teploty topenia sa pohybujú od 750 do 2000 ° C a niekedy sú vyššie.
Z umelých kremičitanov sú najdôležitejšie sklo, cement a keramika.
Zloženie obyčajného okenného skla je približne vyjadrené vzorcom Na20C03O6Si02. Sklo sa vyrába tavením zmesi uhličitanu sodného Na2C03, vápna CaC03 a bieleho piesku Si02 v špeciálnych peciach.
Si02Na2C03 = Na2Si03C02
Si02 CaC03 = CaSi03C02
Na2Si03CaSi03jSi02 = Na20C03O6Si02
Pri špeciálnom skle zmeňte zloženie východiskovej zmesi. Nahradiť sódu uhličitanom sodným Na2C03 K 2 CO 3, dostať žiaruvzdorné sklo (pre chemické pomôcky). Nahradiť oxid kriedový CaCO 3 olovo (II) PbO a sóda s obsahom potaše, dostať krištáľové sklo. Prídavok oxidov kovov k počiatočnej zmesi dáva sklu inú farbu: oxid chrómový (III) Cr2O3 - zelený, oxid kobaltu (Co) CoO - modrý, oxid manganičitý (M) MnO 2 - červeno-fialová atď.
S rastúcou teplotou sa sklá postupne zjemňujú a stávajú sa tekutými. Spätný proces sa vykonáva postupne - sklenená hmota sa pri ochladzovaní zahusťuje. Lisovanie z neho je založené na tejto sklárskej vlastnosti.
Rôzne produkty. S pomocou strojov zo skleneného masového ťahaného skla.
cement
Bežný silikátový cement alebo portlandský cement je zelenošedý prášok, ktorý po zmiešaní s vodou tuhne vo vzduchu (alebo vo vode) na kamennú hmotu. Zvyčajne sa získava pražením (1400 - 1600 ° C) pred spekaním surovinovej zmesi pozostávajúcej z vápenca a ílu.
Po vytvrdnutí vytvára zmes cementu, vody a kameniva (piesok, štrk, drvený kameň, troska) umelý kameň - betón. Betón s oceľovou výstužou sa nazýva železobetón. Betóny, v ktorých sa ako spojivo spolu s cementom používajú organické polyméry alebo polyméry, sa nazývajú plastový betón.
keramika
Keramika označuje materiály a rôzne výrobky vyrobené z prírodných ílov a ich zmesí s minerálnymi prísadami, ako aj oxidov a iných anorganických zlúčenín, lisovaním, pražením a sušením. Sú to tehly, obkladačky, dlaždice, rúrky, keramika, porcelán a fajáns.
Výroba skla, cementu a keramiky patrí do silikátového priemyslu, ktorý spracováva prírodné zlúčeniny kremíka.
Ľudstvo sa zoznámilo so silikónom v staroveku. Z tejto látky primitívni ľudia robili svoje nástroje. A oveľa neskôr to bolo na základe kremíka, že ľudia robili sklo. Napriek tomu, že zlúčeniny kremíka sú známe už veľmi dlho, čistý kremík sa získal relatívne nedávno. Veľký vedec Berzelius v roku 1823 bol schopný získať čistý amorfný kremík, av roku 1854 A. St. Clair Devil dostal kryštalický kremík. Názov prvku v preklade znamená „tvrdý kameň“, ktorý ho celkom správne charakterizuje. fyzikálnych vlastností.
V prírode sa kremík nenachádza v jeho čistej forme, najčastejšie je to oxid kremičitý, minerály alebo soli kyseliny kremičitej.
Mimoriadne dôležité sú minerály na báze kremíka. Kremík je základom takých minerálov, ako je kamienok, azbest, otocláza, živec, kremeň a kryštál. Tieto minerály tvoria celé hory a mnohé piesky nie sú ničím iným ako rozdrveným kremeňom s mnohými nečistotami. Kremík nie je bežný u zvierat a rastlín. Jeho množstvo v tkanivách živých bytostí je malé a jeho vek klesá.
Kremík sa získava redukciou jeho oxidu pri vysokých teplotách:
Si02 + C = Si + 2CO
3Si02 + 4Al = 3Si + 2Al203
Kremík môže byť získaný tepelným rozkladom silánu (vodíková zlúčenina kremíka).
Kremík je typický nekov, má všetky typické vlastnosti svojej skupiny.
1) Interakcia s kyslíkom
Získaný oxid kremičitý 4 je inertný vo svojich vlastnostiach, je obtiažne reagovať, ale aktívne reaguje s kyselinou fluorovodíkovou:
4HF + Si02 = SiF4 + 2H20
2) Interakcia s halogénmi
Pri izbovej teplote reaguje kremík len s fluórom, pri zahrievaní reaguje s chlórom.
Si + 2Cl2 = SiCl4
3) Interakcia s uhlíkom
Si + C = Si +4 C -4
Výsledkom tejto reakcie je získanie karborunda. Má jedinečné fyzikálne vlastnosti: jeho sila je podobná sile diamantu.
V karborunde uhlík vykazuje negatívny oxidačný stav a kremík, pozitívny, vzhľadom na polohu týchto prvkov v periodickej tabuľke.

4) Interakcia s kovmi
Si + 2Mg = Mg2Si
Si + 4Na = Na4Si
Získané látky sa nazývajú silicidy. Keď na ne pôsobia silné kyseliny, uvoľňuje sa silanový plyn, ktorý svojimi chemickými vlastnosťami silne pripomína alkány, ale je oveľa menej stabilný v dôsledku dlhej dĺžky väzby.
5) Získanie oxidov
na zvýšená teplota kremík je schopný regenerovať mnohé kovy zo svojich oxidov.
2CuO + Si = Si02 + 2Cu
6) Interakcia s alkáliami
Pri zvýšených teplotách reaguje kremík s alkalickými roztokmi.
Si + 2NaOH + H20 = Na2Si03 + 2H2 (metaxylát sodný)
Si + 4NaOH = Na4Si03 + 2H2 (ortoxylát sodný)
vlastnosti
14 Si.|
Atómová hmota |
clarke, at.% (prevalencia v prírode) |
||
|
Elektronická konfigurácia * |
Stav agregácie |
pevná látka |
|
|
tmavo šedá lesklá |
|||
|
Ionizačná energia
|
|||
|
Relatívna elektro-negativita |
hustota |
||
|
Možné oxidačné stavy |
Štandardný potenciál elektród |
* Konfigurácia vonkajších elektronických úrovní atómu prvku. Konfigurácia zostávajúcich elektronických úrovní sa zhoduje s konfiguráciou ušľachtilého plynu, ktorý dokončuje predchádzajúce obdobie a je uvedený v zátvorkách.
Byť v prírode.
Kremík po kyslíku je najčastejším prvkom v kôre. Na rozdiel od uhlíka vo voľnom stave sa kremík nenachádza v prírode. Jeho najčastejšie zlúčeniny sú oxid kremičitý (IV) Si02 a soli kyseliny kremičitej - \\ t kremičitany. Tvoria škrupinu zemskej kôry. Zlúčeniny kremíka sa nachádzajú v rastlinách a zvieratách.Prírodné silikáty majú komplexné zloženie a štruktúru. Tu je zloženie niektorých prírodných silikátov: živca K
2 o × Al203 × 6SiO 2, azbest 3 Mg O × 2Si02 X 2H20, cľudí K 2 O × 3 A202 × 6 SiO 2 × 2H 2 O,kaolinit 3 AI203 × 2SiO2 × 2H20.Tiež sa nazývajú kremičitany obsahujúce oxid hlinitý hlinitokremičitany. Z vyššie uvedených kremičitanov sú hlinitokremičitany živce, kaolín a sľuda. V prírode sú najčastejšie hlinitokremičitany, ako napríklad živce. Bežné sú aj zmesi rôznych silikátov. Skaly - žuly a ruly - sú zložené z kremenných kryštálov, živca a sľudy.
.Hlavným produktom deštrukcie je minerál kaolinitu - hlavná zložka bielej hliny. V dôsledku zvetrávania hornín sa vytvorili usadeniny ílu, piesku a solí.
Získanie. Priemysel výroby kremíka sa vyrába zhodnocovaním
Si02 koks v elektrických peciach:V laboratóriu ako redukčné činidlo s použitím horčíka alebo hliníka:
Najčistejší kremík sa získa redukciou tetrachlórmetánu parami zinku:
Aplikácie.
Ako polovodič sa používa kremík. Z neho sa vyrábajú tzv. Solárne články, ktoré premieňajú svetelnú energiu na elektrickú energiu (napájanie rádiových zariadení kozmickej lode). Kremík sa používa v metalurgii na výrobu kremíkových ocelí s vysokou tepelnou odolnosťou a odolnosťou voči kyselinám.Fyzikálne vlastnosti. Kryštalický kremík je tmavosivá látka s oceľovým leskom. Štruktúra kremíka je podobná štruktúre diamantu. Vo svojom kryštáli je každý atóm obklopený štvorstennými štyrmi ďalšími a je s nimi spojený kovalentnou väzbou, ktorá je oveľa slabšia ako medzi atómami uhlíka v diamante. V kremíkovom kryštáli, aj za normálnych podmienok, sú niektoré kovalentné väzby zničené. Preto má voľné elektróny, ktoré spôsobujú malú elektrickú vodivosť. Keď osvetlenie a kúrenie zvyšuje počet rozbitých väzieb, čo znamená, že sa zvyšuje počet voľných elektrónov a elektrická vodivosť sa zvyšuje. Tak by sa mali vysvetliť polovodičové vlastnosti kremíka.
Kremík je veľmi krehký, jeho hustota je 2,33 g / cm3 , Rovnako ako uhlie sa vzťahuje na žiaruvzdorné látky.
Kremík pozostáva z troch stabilných izotopov: 28 14 Si (92,27%), 29 14 Si (4,68%) a 30 14 Si (3,05%).
Chemické vlastnosti
Podľa chemických vlastností je kremík, podobne ako uhlík, nekovový, ale jeho nemetalicita je menej výrazná, pretože má väčší atómový polomer. Pretože atómy kremíka majú 4 elektróny na vonkajšej úrovni energie, oxidačný stav -4 a +4 je charakteristický pre kremík (zlúčenina kremíka je známa, kde je stupeň oxidácie +2).Kremík za normálnych podmienok je skôr inertný, čo by malo byť vysvetlené silou jeho kryštalickej mriežky. Priamo interaguje iba s fluórom:
![]()
Kyseliny (okrem fluorovodíkovej zmesi)
HF a dusík HNO3 a) nepôsobia na kremík. Rozpúšťa sa však v hydroxidoch alkalických kovov, pričom vzniká silikát a vodík:Z dvoch alotropických modifikácií kremíka, kryštalického a amorfného, je amorfný kremík chemicky účinnejší. Reaguje s kyslíkom pri zahrievaní, tvárnení
SiO 2:![]()
a tiež so všetkými halogénmi, napríklad:
![]()
Pri vysokých teplotách sa silikón kombinuje s uhlíkom a vytvára sa carborundum
SiC:![]()
Carborundum má kryštálovú mriežku podobnú diamantu, v ktorej je každý atóm kremíka obklopený štyrmi atómami uhlíka a naopak, kovalentné väzby sú veľmi silné, ako v diamante. Preto je v tvrdosti blízko diamantu. Brúsne kamene a brúsne kotúče sú vyrobené z karbidu kremíka.
Silicid horečnatý. Pri reakciách s aktívnymi kovmi, vyskytujúcich sa pri tvorbe kremičitan, Kremík pôsobí ako oxidačné činidlo:
![]()
Pri vysokých teplotách obnovuje kremík mnoho kovov zo svojich oxidov.
Silan. Pod pôsobením kyseliny chlorovodíkovej na silicidy získajte najjednoduchšiu vodíkovú zlúčeninu kremíka silan
SiH 4: - jedovatý plyn s nepríjemným zápachom, samovznietivý vo vzduchu:Oxid kremičitý
(IV).Oxid kremičitý (IV) sa tiež nazýva oxid kremičitý. Je to pevná žiaruvzdorná látka.(bod topenia 1700 ° C), rozšírený v prírode v dvochformy: 1) kryštalický kremík - vo forme minerálu kremeňa a jeho odrôd (skalný kryštál, chalcedón, achát, jasper, pazúrik); kremeň tvorí základ kremenných pieskov široko používaných v stavebníctve av silikátovom priemysle; 2) amorfný oxid kremičitý - vo forme opálového minerálneho zloženia Si02 × n H2 O; zemité formy amorfného oxidu kremičitého sú diatomit, tripoli (infusorial earth); Príkladom umelého amorfného bezvodého oxidu kremičitého je silikagél, ktorý sa získava z metakremičitanu sodného:
Silikagél má vyvinutý povrch, a preto dobre absorbuje vlhkosť.
Pri teplote 1710 ° C sa taví kremeň. S rýchlym ochladzovaním roztavenej hmoty
vznikne kremenné sklo. Má veľmi nízky koeficient expanzie, takže horúce kremenné sklo nepraská, keď sa voda rýchlo ochladzuje. Laboratórne sklo a nástroje pre vedecký výskum sú vyrobené z kremenného skla.Najjednoduchší vzorec oxidu kremičitého (IV) SO2 podobný vzorcu oxidu uhoľnatého (IV) C02 , Medzitým sú ich fyzikálne vlastnosti veľmi odlišné (SiO 2 - tuhý CO 2 - plyn). Tento rozdiel je spôsobený štruktúrou kryštálových mriežok. C0 2 kryštalizuje v molekulárnej mriežke, SiO 2 - v atómovej. štruktúraSi02 v planárnom obraze môže byť reprezentovaný ako: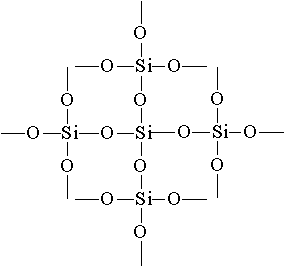
Koordinačné číslo atómu uhlíka v tuhej С
02 sa rovná 2 a silikónu v Si02 Každý atóm kremíka je uzavretý v tetraedróne 4 atómov kyslíka. V tomto prípade je atóm kremíka umiestnený v strede a atómy kyslíka sú umiestnené na vrchoch tetraedrónu. Celý kus oxidu kremičitého možno považovať za kryštál, ktorého vzorec (Si02) n. Takáto štruktúra oxidu kremičitého (IV) určuje jeho vysokú tvrdosť a žiaruvzdornosť.Chemické vlastnosti oxidu kremičitého (IV) \\ t
Si02 Výraz "oxidy kyselín" označuje oxidy kyselín. Pri jeho tavení s tuhými zásadami, zásaditými oxidmi a uhličitanmi sa tvoria soli kyseliny kremičitej: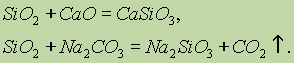
S oxidom kremičitým (IV) interaguje iba kyselina fluorovodíková:
Pri tejto reakcii sa sklo leptá.
Oxid kremičitý sa nerozpúšťa vo vode a s ním chemicky neinteraguje. Kyselina kremičitá sa preto získava nepriamo pôsobením kyseliny na roztok kremičitanu draselného alebo sodného: \\ t
V tomto prípade kyselina kremičitá
(v závislosti od koncentrácie východiskových roztokov soli a kyseliny) sa môže získať ako vo forme želatínovej hmoty obsahujúcej vodu, tak vo forme koloidného roztoku (sol).Kyselina kremičitá.
Si02 "Anhydrid kyseliny kremičitej" je anhydrid radu kyselín kremičitých, ktorých zloženie môže byť vyjadrené všeobecným vzorcom xSi02 × yH20, kde x a y - celé čísla: = 1, y = 1: SiO2 × H 2 O, t.j. kyselina metakremičitá;2) x = 1, y = 2: Si02 × 2H20, t.j. H 4 SiO 4 - kyselina ortokremičitá;
x = 2, y = 1: 2Si02 × H 2 O, t.j. kyselina bimetakrynová. Kyselina kremičitá je vytvorená z tetraedrických štruktúrnych jednotiek (v každej takejto jednotke je atóm kremíka v strede tetraedrónu a v jeho vrchole sú atómy kyslíka). Štrukturálne väzby, spájajúce sa v reťazcoch, tvoria stabilnejšie polysilikónové kyseliny:
Zloženie takýchto zlúčenín môže byť vyjadrené vzorcom
(H2Si03) n. Obvykle je však kyselina kremičitá reprezentovaná vzorcom H2Si03. H 2 SiO 3 - kyselina je veľmi slabá, mierne rozpustná vo vode. Pri zahriatí sa ľahko rozkladá ako kyselina uhličitá:Všetky kyseliny kremičité sú veľmi slabé (slabšie ako uhlie).
Kremičitany.
Nazývajú sa soli všetkých kyselín kremičitých silikáty, síce spravidla vo vzdelávacej literatúre znamenajú silikáty soli kyseliny metakremičitej. Ich zloženie je zvyčajne reprezentované vzorcom vo forme zlúčenín oxidov prvkov. Napríklad kremičitan vápenatý CaSi03 môže byť vyjadrený ako: Cao ×Si02.Silikátové zloženie
R20 × nSiO 2, kde R20 - oxidov sodíka alebo draslíka rozpustné sklo a ich koncentrované vodné roztoky - \\ t tekuté sklo. Najdôležitejšie je sklo rozpustné v sodíku.Pri státí vo vzduchu sa roztoky kremičitanov zakalia, pretože oxid uhličitý (IV) vo vzduchu vytláča kyselinu kremičitú zo svojich solí:
Kyselina kremičitá je prakticky nerozpustná vo vode - táto vlastnosť sa používa ako kvalitatívna reakcia na ión
Si02 - .Silikáty sa získavajú tavením oxidu kremičitého alkalickými alebo karbonátmi:
Aplikácia silikátov.
Najčastejšie používané silikáty sú sodík a draslík. Nazývajú sa koncentrované roztoky týchto solí tekuté sklo; majú silne alkalickú reakciu v dôsledku hydrolýzy. Tekuté sklo sa používa pri výrobe lepidiel a vodotesných tkanín. Tekuté sklo sa používa ako spojivo pri výrobe betónov odolných voči kyselinám, ako aj pri výrobe tmelu, kancelárskeho lepidla. Sú impregnované tkaninou, drevom a papierom, aby poskytli požiarnu odolnosť a vodotesnosť.Copyright © 2005-2013 Xenoid v2.0
Použitie materiálov je možné za predpokladu, že je označené aktívne spojenie.
| Súvisiace články: | |
|
Prečo je prudký nárast krvného tlaku?
Najviditeľnejšie príznaky vysokého krvného tlaku sú bolesti hlavy, ... \\ t Váha stojí - čo robiť, ako schudnúť, ako ju znížiť
Počas dlhšieho úbytku hmotnosti čelia takmer všetci problémy ... Spôsoby Bitcoin zarábať na stroji
VkontakteOdnoklassniki Dnes Bitcoins (peniaze elektronické platby ... | |