მკითხველის არჩევანი
პოპულარული სტატიები
შესავალი
თქვენს ბინაში სარემონტო, და თქვენ უნდა შეიძინოთ კერამიკული ფილები. მაღაზიაში, სხვადასხვა ფორმებისა და ფერების დახარისხებისას, თქვენ იპოვეს უფლება და შეამოწმეთ შეკვეთა, პაკეტის ამ ნაწილში ნახატზე, სადაც მისი კომპოზიცია დაიწერა. თითქმის ყველა ინგრედიენტი ნაცნობია, მაგრამ ერთი მათგანი გაგიკვირდებათ - სილიკონის ოქსიდი. ბუნებრივია, თქვენ გაინტერესებთ მასზე. დღეს მე შევეცდები თქვენი ინტერესის დაკმაყოფილებას.
განმარტება
სილიკონის აქვს ცვლადი valence, და ამის გამო, ქიმიაში, მისი ორი ნაერთების ჟანგბადის ცნობილია. დღეს ჩვენ ვხედავთ მაღალ სილიციუმს, რომელშიც ეს უკანასკნელი აქვს IV.
სახელი
სხვადასხვა წყაროდან შეიძლება სილიციუმის დიოქსიდი, სილიკა ან სილიკა.
თვისებები
ეს არის მჟავე ოქსიდი, რომელიც რთული და გრძელვადიანი. თუკი ეს არის მწვავე და ნებისმიერი ტუტე / ძირითადი ოქსიდი, ისინი ურთიერთქმედებენ ერთმანეთთან. ეს სილიკონის ნაერთი არის მინის ყოფილი, ანუ ეს შეიძლება გამოიწვიოს supercooled დნება - მინა.  ასევე (მისი სუფთა სახით) იგი არ გაივლის ელექტრო მიმდინარე (არის დიელექტრიკული). სილიკონის ოქსიდი აქვს ატომური ბროლის ფარში. მჟავების მიმართ მდგრადია, მაგრამ გამონაკლისია ჰიდროფუორიური და აირისებრი წყალბადის ფლუოდიდი. ამ უკანასკნელთან რეაქციის პროდუქტები სილიციუმის ფტორისა და წყლისაა. თუ მეორე რეაქტივის არის წყალბადის ფტორს გადაწყვეტა, მაშინ მისი პროდუქცია იქნება ჰექსფლუროოზული მჟავა და იგივე წყალი. თუ სილიციუმი (IV) ტუტე / ძირითადი ოქსიდის / კარბონატის ნებისმიერი აქტიური ლითონისაა, რეაქციის პროდუქტი იქნება სილიკატური მარილი სილიკატი, რომლის მხოლოდ კალიუმი და ნატრიუმის სილიკატები ხსნილია. ნებისმიერი უკანასკნელი წყლით ურთიერთქმედების პროდუქცია თხევადი მინაა. მათ აქვთ მკაცრად ტუტე გარემო, ამის მიზეზი ჰიდროლიზია. ჰიდროლიზირებული სილიკატები არ არიან ჭეშმარიტი, მაგრამ კოლოიდური გადაწყვეტილებები. თუ კალიუმის ან ნატრიუმის სილიკატების მიღება ოდნავ ოქსიდაზდება, მოხდება ჟელატინის თეთრი ნალექი, რომელიც შედგება ჰიდრატირებული სილიციუმის მჟავისგან.
ასევე (მისი სუფთა სახით) იგი არ გაივლის ელექტრო მიმდინარე (არის დიელექტრიკული). სილიკონის ოქსიდი აქვს ატომური ბროლის ფარში. მჟავების მიმართ მდგრადია, მაგრამ გამონაკლისია ჰიდროფუორიური და აირისებრი წყალბადის ფლუოდიდი. ამ უკანასკნელთან რეაქციის პროდუქტები სილიციუმის ფტორისა და წყლისაა. თუ მეორე რეაქტივის არის წყალბადის ფტორს გადაწყვეტა, მაშინ მისი პროდუქცია იქნება ჰექსფლუროოზული მჟავა და იგივე წყალი. თუ სილიციუმი (IV) ტუტე / ძირითადი ოქსიდის / კარბონატის ნებისმიერი აქტიური ლითონისაა, რეაქციის პროდუქტი იქნება სილიკატური მარილი სილიკატი, რომლის მხოლოდ კალიუმი და ნატრიუმის სილიკატები ხსნილია. ნებისმიერი უკანასკნელი წყლით ურთიერთქმედების პროდუქცია თხევადი მინაა. მათ აქვთ მკაცრად ტუტე გარემო, ამის მიზეზი ჰიდროლიზია. ჰიდროლიზირებული სილიკატები არ არიან ჭეშმარიტი, მაგრამ კოლოიდური გადაწყვეტილებები. თუ კალიუმის ან ნატრიუმის სილიკატების მიღება ოდნავ ოქსიდაზდება, მოხდება ჟელატინის თეთრი ნალექი, რომელიც შედგება ჰიდრატირებული სილიციუმის მჟავისგან.
მიღება
ინდუსტრიაში, სილიციუმის ოქსიდი მიიღება გათბობის სილიციუმში ჟანგბადის გარემოში. ეს იჟანგება და ქმნის სასურველ პროდუქციას. იგი ასევე დანაღმული თერმული დაჟანგვის. ლაბორატორიულად, სილიციუმის ოქსიდი მიიღება ნებისმიერი მჟავების მოქმედებით ხსნადი სილიკატი, ამასთან კი სუსტი ძმარმჟავაც არის შესაფერისი. მაგალითად, თუ დააკმაყოფილებთ მას ნატრიუმის სილიკატს, რეაქციის პროდუქტი იქნება ნატრიუმის აცეტატი და სილიციუმის მჟავა. ამ უკანასკნელის დაშლა დაუყოვნებლივ გაიმართება და მისი დეკორაციის პროდუქტები იქნება წყალი და საჭირო ოქსიდი.
 განაცხადი
განაცხადი
დამზადებულია სილიკონის ოქსიდის, მინის, კერამიკის, აბრაზივით, ბეტონის პროდუქტების გამოყენებით და მზადდება სილიციუმი. იგი ასევე წარმოადგენს შემავსებელს რეზინის ინდუსტრიაში. სილიკონის ოქსიდის ამორფული მოდიფიკაციის კრისტალები - კვარცის მინის - აქვს piezoelectric თვისებები, და შემქმნელთა რადიო საინჟინრო, ულტრაბგერითი სისტემები და სანთებელები გამოიყენოს ეს. სილიკატები და სილიკატები - ლითოსფეროს მასის თითქმის 90%. სილიკონის ოქსიდი ასევე ცნობილია, როგორც საკვები დანამატი E551. ეს არის მისი ამორფული არასამთავრობო ფოროვანი ჯიში. ეს ხელს უშლის საჭმლის კბილებს და კვებავს, ფარმაცევტულ პრეპარატებში გამოიყენება დამხმარე ნივთიერება და ენდოზორბენტური პრეპარატი. ამ ოქსიდის ფილმებს წარმოადგენს იზოლატორი, როდესაც წარმოიქმნება მიკროჩიპები და სხვა ელექტრონული კომპონენტები. ისინი ასევე ქმნიან ოპტიკურ-ბოჭკოვანი კაბელები. და ელექტრონული სიგარეტის გათბობის ელემენტები შეუძლებელი იქნება სილიკის ძაფის გარეშე.
დასკვნა
ეს არის ის, თუ რამდენად ფართოდ გამოიყენება ოქსიდი. და დაინახავთ, რომ თქვენ არ გჭირდებათ მაღაზიაში და ცნობისმოყვარეობაზე, რათა განიხილონ ცემენტი და ბეტონი. ბუნებრივი სილიკა არის ჩვენი ფეხები - ეს არის ჩვეულებრივი ქვიშა. გამოდის, რომ ეს შეიძლება სასარგებლო იყოს.
სილიკონი. ატომის, კრისტალური სილიკონის სტრუქტურა, მისი თვისებები და აპლიკაციები. სილიკონის ოქსიდი (IV), მისი ბუნებრივი ჯიშები. სილიკატები. სილიკონის ნაერთების ღირებულება animate და inanimate ბუნებაში. კონცეფცია სილიკატური ინდუსტრია.
თემა: სილიკონი. ატომის, კრისტალური სილიკონის სტრუქტურა, მისი თვისებები და აპლიკაციები. სილიკონის ოქსიდი (IV), მისი ბუნებრივი ჯიშები. სილიკატები. სილიკონის ნაერთების ღირებულება animate და inanimate ბუნებაში. კონცეფცია სილიკატური ინდუსტრია.
გეგმა
1. ატომის სტრუქტურა
2. სილიციუმის ფიზიკური და ქიმიური თვისებები.
3. მიღება სილიციუმის მჟავა.
4. სილიკატები. სამშენებლო მასალები.
ლიტერატურა:
1823 წელს შვეიცარიელი ქიმიკოსი იენს იაკობ ბერზელიუსი აღმოაჩინა და მიიღო სილიკონი. მეორე ყველაზე გავრცელებული ელემენტია დედამიწის ქერქში ჟანგბადის შემდეგ (27.6% წონა). ის გვხვდება ნაერთებში.
ნიადაგის სილიციუმის ატომის სტრუქტურა:
1s 2 2s 2 2p 6 3s 2 3p 2
სილიკონის ატომის სტრუქტურა აღგზნებულ მდგომარეობაში:
1s 2 2s 2 2p 6 3s 1 3p 3
კრისტალური სილიკონი - მუქი ნაცრისფერი ნივთიერება მეტალის შუასადებით, დიდი სიმტკიცე, მწარე, ნახევარგამტარი; ρ = 2.33 გ / სმ3 , t ° pl. = 1415 ° C; tip kip = 2680 ° C. მას აქვს ალმასის მსგავსი სტრუქტურა და ქმნის ძლიერ კოვალენტურ ობლიგაციებს. არის ინერტული.
ამორფული სილიციუმი- ყავისფერი ფხვნილი, ჰიპროსკოპიული, ალმასის მსგავსი სტრუქტურა, ρ = 2 გ / სმ3 უფრო რეაქტიული.
სილიკონის მიღება
ინდუსტრიაში - ქვიშის ქვაბში ქვიშა:
2C + SiO 2 ˚ → Si + 2CO
ლაბორატორიაში - მაგნიუმით ქვიშის გაცხელება :
2 მგ + SiO 2 ˚ → Si + 2MgO
ქიმიური თვისებები
ტიპიური არალეტალური, ინერტული.
როგორც შემცირების აგენტი:
Si 0 + O 2 t˚ → Si + 4 O 2
Si 0 + 2F 2 → SiF 4
Si 0 + C tz → Si +4 С
(SiC - carborundum - მყარი; გამოიყენება წერტილი სახეხი;)
სილანე (SiH 4 ) მიიღება მჟავით ლითონის სილიციდების დაშლა.
Mg 2 Si + 2H 2 SO 4 → SiH 4 + 2MgSO 4
3Si + 4HNO 3 + 18HF → 3H 2 + 4NO + 8H 2 O
როგორც oxidizer:
Si 0 + 2 მგ ˚ → Mg 2 Si-4
სილიკონის გამოყენება:
სილიკონის ფართოდ გამოიყენება ელექტრონიქსი, როგორც ნახევარგამტარი. შენადნობის სილიციუმის გაზრდა მათი კოროზიის წინააღმდეგობას ზრდის. სილიკატები, ალუმინოლაკატები და სილიკა - მინა და კერამიკული წარმოების ძირითადი ნედლეული მასალა, ასევე სამშენებლო ინდუსტრია.
Silane - SiH 4
ფიზიკური თვისებები: უცხიმო გაზი, შხამიანი, t ° pl. = -185 ° C, tip kip. = -112 ° C
მიღება : Mg 2 Si + 4HCl → 2MgCl 2 + SiH 4
ქიმიური თვისებები:
სილიკონის ოქსიდი (IV) - (SiO2) ნ
SiO 2 - კვარცი, rhinestone, ამეთვისტო
,
აქატი, იასპერი, ორალი
, სილიკა (ქვიშის ნაერთი). სილიკონის ოქსიდის (IV) ბროლის ლატი არის ატომური და აქვს შემდეგი სტრუქტურა: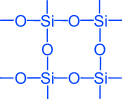

ალ 2 O 3 2SiO 2 2H 2 ო - კაოლინი (თიხის ძირითადი ნაწილი)
K 2 O ალ 2 O 3 6SiO 2 - orthoclase (feldspar)
ფიზიკური თვისებები:მყარი, კრისტალური, ცეცხლგამძლე ნივთიერება, t ° = 1728 ° C, t ° kip = 2590 ° C
ქიმიური თვისებები:
მჟავა ოქსიდი. როდესაც იწვევენ ურთიერთქმედებებს ძირითადი ოქსიდების, ალკალის, ასევე ტუტე და ტუტე დედამიწის ლითონების კარბონატები.
სიო 2 + CaO t˚ → CaSiO 3
SiO 2 + 2NaOH t˚ → Na 2 SiO 3 + H 2 O
SiO 2 + CaCO 3 t˚ → CaSiO 3 + CO 2
SiO 2 + K 2 CO 3 t˚ → K 2 SiO 3 + CO 2
SiO 2 + 4HF tz → SiF 4 + 2H 2 O
SiO 2 + 6HF ˚ → H 2 (ჰექსფლუროოზულური მჟავა) + 2H 2 O)
(რეაქციები ხაზს უსვამს მინის ჭერის პროცესს).
განაცხადი:
2. მიღების სილიციუმის მჟავა.
x SiO 2 y H 2 O 
x = 1, y = 1 H 2 SiO 3 - მეტაბილური მჟავა
x = 1, y = 2 H 4 SiO 4 - ორთოზილიკური მჟავა და ა.შ.
ფიზიკური თვისებები: H 2 SiO 3 - ძალიან სუსტი (სუსტი, ვიდრე ნახშირი), მყიფე, ოდნავ ხსნადი წყალში (ქმნის კოლოიდურ გადაწყვეტას), არ აქვს მჟავე გემო.
მიღება:
ეფექტი ძლიერი მჟავების შესახებ silicates - Na2 SiO 3 + 2HCl → 2NaCl + H 2 SiO 3 ↓
(სილიკას ლარის მოპოვება, სილიციუმის მჟავის მოპოვება)
ქიმიური თვისებები:
სილიციუმის მჟავას უწოდებენ -სილიკატები.
Na 2 SiO 3 + H 2 O + CO 2 = Na 2 CO 3 + H 2 SiO 3
Na 2 SiO 3 + CaCl 2 = 2NaCl + CaSiO 3 ↓
(K 2 O Al 2 O 3 6SiO 2) (feldspar) + CO 2 + 2H 2 O → (ალ 2 O 3 2SiO 2 2H 2 ო) (კაოლინიტი (თიხა)) + 4 ს2 (სილიკა (ქვიშა)) + კ2 CO 3
კალიუმის სილიკატის ხსნარით ტესტის მილით, დაამატეთ ჰიდროქლორინის მჟავას ხსნარი. თეთრი ნახევრად მყარი მასა ჩამოყალიბდა ვიტრო-სილიციუმის მჟავაში.
Na 2 SiO 3 + HCl = 2NaCl + H 2 SiO 3 
სილიციუმის ნაერთების გამოყენება
ბუნებრივი სილიციუმის ნაერთები - ქვიშა (SiO2 ) და სილიკატები გამოიყენება კერამიკის, მინისა და ცემენტის წარმოებისთვის.
ჩვეულებრივი ფანჯრის შუშის შემადგენლობა დაახლოებით გამოხატულია ფორმულა Na2O CaO 6 SIO- ს მიერ2 . შუშის დამზადებულია სპეციალურ ღუმელებში ნაჭოვანი სოდა ნარევით.2 CO 3 კირქვის კაზო3 და თეთრი ქვიშა SIO2.
3. სილიკატები. სამშენებლო მასალები.

კერამიკა |
|
ფაიფური = კაოლინი + თიხა + კვარცი + ფელდსპარ. სამთო ფაიფური - ჩინეთი, სადაც ფაიფური უკვე ცნობილია 220 გ. 1746 წელს რუსეთში ფაიფური წარმოება ჩამოყალიბდა
| ფაიენს - იტალიის ქალაქ ფაენცას სახელიდან. სადაც მე -14 და მე -15 საუკუნეებში შეიქმნა კერამიკული ხელნაკეთობა. ფაიენსი - განსხვავდება ფაიფურისგან თიხის მაღალი შემცველობის (85%), ქვედა დამწვრობის ტემპერატურაზე.
|
მინა არის მყიფე, გამჭვირვალე მასალა, რომელსაც შეუძლია შეარბილოს და იღებს ნებისმიერ ფორმას, როდესაც განკურნება. მინის მზადდება სამზარეულო Batch (ნედლეული, რომელიც შედგება ქვიშა, სოდა და კირქვა) სპეციალურ მინის დნობის ღუმელებში.


ძირითადი რეაქცია, რომელიც ხდება დამონტაჟების დროს
1. Na 2 CO 3 + SiO 2 = Na 2 SiO 3 + CO 2
2. CaCO 3 + SiO 2 = CaSiO 3 + CO 2
3. Na 2 SiO 3 + CaSiO 3 + 4SiO 2 = Na 2 O * CaO * 6SiO 2 - ფანჯრის მინის ფორმულა
R სილიკატები2 შესახებ NSiO 2, დე R 2 O - ოქსიდები ნატრიუმის ან კალიუმის, ე.წ. ხსნადი მინა და მათი კონცენტრირებული გადაწყვეტილებები - თხევადი მინა.
ხშირად წარმოების მინის, სოდა შეიცვალა ნატრიუმის სულფატი და ქვანახშირის. ამ შემთხვევაში, ნატრიუმის სილიკატი იქმნება რეაქციის განტოლების მიხედვით:
როდესაც ტყვიის ოქსიდი დაემატება, ბროლის მიღება ხდება. სპეციალური მინის წარმოებისათვის პირველადი ნარევის შემადგენლობა შეიცვლება. შეცვალეთ Na Soda2 CO 3- ს მივცემთ K 2 CO3- ს , მიიღეთ ცეცხლგამძლე მინის (ქიმიური მინისთვის). ლითონის ოქსიდების დანამატები გამონაბოლქვამდე უნდა შეიტანოს სხვადასხვა ფერის: ქრომის ოქსიდი - (III) Cr2 o 3 მწვანე, კობალტის (II) ოქსიდი CoO - ლურჯი, მანგანუმის (IV) ოქსიდის MpO2 - წითელი ლალიკა.
ცემენტი 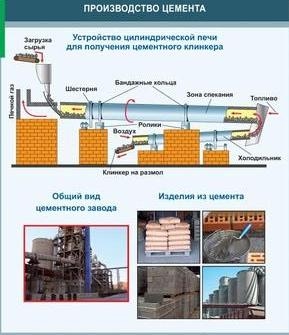

რეგულარული სილიკატური ცემენტი არის მომწვანო ნაცრისფერი ფხვნილი, როდესაც წყლის შერევა, ჰაერში ან წყლის (ან წყალში) ქრება, ქვის მსგავსი მასა. ეს ჩვეულებრივ მიღებული calcining (1400-1600 ° C) for შედუღების ნედლეული mix, რომელიც შედგება კირქვის და თიხის. კალკულაცია ხორციელდება სპეციალური ცილინდრული შექცევადი ღუმელით.კლინკერი - მუქი ნაცრისფერი ფერის ბურთები გამოიმუშავებს თიხისა და კირქვის სპეციალური მბრუნავი ბოჭკოებით. შერევით შემადგენლობა ნარევი, მიიღეთ სხვადასხვა ტიპის ცემენტი - სწრაფად გამკვრივება, ყინვაგამძლე მდგრადი, კოროზიის მდგრადი. ცემენტის, წყლისა და შემავსებლის (ქვიშის, ხრეშის, გაანადგურული ქვის, წიდის) ნარევიდან, მათი გამკვრივების შემდეგ, ხელოვნური ქვის მოპოვება ხდება - ბეტონი. ამ მასალის ნარევი გაამყარებს კონკრეტულ ნაზავს. როდესაც გაბრაზებული, ცემენტის პასტა აყენებს მარცვლეულის შემავსებლები. გამძლეობა ხდება წყალშიაც. ბეტონის ფოლადის გაძლიერება (შიდა ჩარჩო) ეწოდება რ / ბეტონის.
დავალების შესრულების ამოცანები:
Si → SiO 2 → Na 2 SiO 3 → H 2 SiO 3 → SiO 2
საშინაო დავალება
ლიტერატურა 3.
მუშაობა §30-33
სილიკონი. Silane, silicides, სილიკონის ოქსიდი (IV). სილიციუმის მჟავები, სილიკატები
8.1. სილიკონი. Silane, silicides
სილიკონი ნახშირბადის ანალოგია, მაგრამ მისი არალითონის თვისებები ნაკლებად გამოხატულია, ვიდრე ნახშირბადის.
სილიკონისთვის, sp3 ჰიბრიდული მდგომარეობა უფრო დამახასიათებელია, ამიტომ სილიციუმს შეუძლია გამოავლინოს ჟანგვის მდგომარეობები 4 და -4 ნაერთებში.
სილიკონი - დედამიწაზე ჟანგბადის შემდეგ ყველაზე გავრცელებული ელემენტია. დედამიწის ქერქში სილიციუმის მასის ფრაქცია 27.6% შეადგენს. ბუნებაში სილიციუმი ვრცელდება ოქსიდის SiO 2 სახით, ასევე უწოდებენ სილიკას, რომელიც ქვიშის ქვიშის სახითაა ნაპოვნი. ბუნებრივი სილიციუმის ნაერთების კიდევ ერთი ჯგუფი სილიციუმის მჟავების - სილიციუმის მჟავას წარმოადგენს. ყველაზე გავრცელებული ალუმინოლიკალიტები, რომლებიც მოიცავს ფელდსპ (ალბბიტის) NaAlSi 3 O 8, ფელდსპ (orthoclase) KAlSi 3 O 8\u003e თიხა (კაოლინი) ალ 2 O 3 2SiO 2 2H 2 O, ნეფინლაინ Na 3 K 4 და ა.შ. ქმნიან დედამიწის ქერქის ჭურვი. სილიკონის ნაერთები გვხვდება მცენარეებსა და ცხოველებში.
მიღება
ინდუსტრიაში, სილიკონი მზადდება SiO 2- ის კოქსის მიერ ელექტრო ღუმელების შემცირებით:
SiO 2 2C = S 2CO
ლაბორატორიაში, როგორც შემცირების აგენტი მაგნიუმის ან ალუმინის გამოყენებით:
SiO 2 2Mg = Si 2MgO 3SiO 2 4Al = 3Si 2Al 2 O 2
ყველაზე სუფთა სილიციუმი მიიღება სილიციუმის ტეტრაქლორიდის შემცირება წყალბადის 1200 ° C: SiCl 4 2H 2 = Si 4HCl
^ ფიზიკური თვისებები
კრისტალური სილიციუმი არის მუქი ნაცრისფერი ნივთიერება ფოლადი ლურსმნებით. სილიკონის სტრუქტურა ალმასის სტრუქტურის მსგავსია. მისი ბროლის, თითოეული ატომი აკრავს ტეტრაჰტრალური ოთხი სხვა და უკავშირდება მათ კოვალენტური ობლიგაციით, რომელიც გაცილებით სუსტია, ვიდრე ალმასის ნახშირბადის ატომებს შორის.
სილიკონის კრისტალში, ნორმალურ პირობებშიც კი, ზოგიერთი კოვალენტური ობლიგაციები განადგურებულია. აქედან გამომდინარე, იგი შეიცავს თავისუფალ ელექტრონებს, რამაც გამოიწვია დაბალი ელექტროგამტარობა. როდესაც განათება და გათბობა ზრდის გატეხილი ობლიგაციების რაოდენობას, რაც იმას ნიშნავს, რომ თავისუფალი ელექტრონების რიცხვი იზრდება და ელექტროგამტარობა იზრდება. ასე რომ, აუხსენით, რომ სილიკონის ნახევარგამტარული თვისებებია. სილიკონი ძალიან მყიფეა, მისი სიმჭიდროვეა 2.33 გ / სმ 3. ნახშირის მსგავსად, სილიკონი არის ცეცხლგამძლე ნივთიერება.
სილიკონის შედგება სამი სტაბილური იზოტოპები: 28 14 Si (92.27%),
29 14 Si (4.68%) და 30 14 Si (3.05%).
^ ქიმიური თვისებები
By ქიმიური თვისებები სილიკონი, ნახშირბადის მსგავსად, არ არის ლითონი, მაგრამ მისი არალითალურობა ნაკლებად გამოხატულია, ვინაიდან მას უფრო დიდი ატომური რადიუსი აქვს. ვინაიდან სილიციუმის ატომებს აქვთ 4 ელექტრონი გარე ენერგეტიკულ დონეზე, ორივე -4 და 4-ის ჟანგვის მდგომარეობა ტიპიურია სილიკონისთვის.
სილიკონი ნორმალურ პირობებში საკმაოდ ინერტულია, რაც აიხსნება მისი ბროლის ლატის სიძლიერით. უშუალოდ ის ხსნის მხოლოდ ფტორს:
Si 2F 2 = SiF 4
დამსხვრეული სილიკონი, როდესაც ჟანგბადის დამწვრობა სილიციუმის ოქსიდის (IV) შევიდა:
Si O 2 = SiO 2
სილიკონი რეაგირებს ქლორთან 400-600 ° C:
Si 2 Cl 2 = SiCl 4
როდესაც ძალიან მაღალი ტემპერატურა სილიკონის შეუძლია პირდაპირ დააკავშიროთ ნახშირბადის და აზოტის:
3Si 2N 2 = Si 3 N 4
სილიციუმის კარბიდი SiC (carborundum) აქვს ალმასის მსგავსი ბროლის lattice, რომელშიც თითოეული სილიკონის ატომის გარშემო ოთხი ნახშირბადის ატომები და პირიქით, და covalent ობლიგაციები ძალიან ძლიერი, როგორც ალმასის. აქედან გამომდინარე, სიახლოვე სიახლოვეა.
ალმასისთვის. Grinding ქვები და grinding ბორბლები მზადდება სილიკონის კარბიდი.
მჟავები (ჰიდროფლორული ჰიდროქლორიდისა და აზოტის HNO 3 ნარევიდან) არ იმოქმედებს სილიციუმზე. თუმცა, ეს იხსნება ტუტეში, სილიკატური და წყალბადის ჩამოყალიბება:
Si 2NaOH H 2 O = Na 2 SiO 3 2H 2
სილიკონი ზოგიერთ ლითონთან - Sn, Al, Zn, Pb, Au, Ag - არ ქიმიურად ურთიერთქმედება. სხვა ლითონებთან ერთად, მაგალითად მგ, Ca, Cu, Fe, Pt, Bi, ის რეაგირებს სილიციდების ფორმირებით:
2Sa Si = Ca 2 Si
სტრუქტურისა და თვისებების მიხედვით, სილიციდები შეიძლება დაიყოს ორ ჯგუფად. პირველი მოიცავს ტუტე და ტუტე დედამიწის ლითონების silicides (Li 4 Si, Ca 2 Si). ისინი წყლისა და განზავებული მჟავებისგან დაიშლება სუნანების გათავისუფლებით:
Ca 2 Si 4HCl = 2CaCl 2 SiH 4
ლითონის მსგავსი სილიციტების ყველაზე საინტერესო ჯგუფი იქმნება გარდამავალი ლითონებით. ამ სილიციტების სტრუქტურაში, სილიციუმის ატომების ჯაჭვები და ფენები ლითონის ბროლის ფარშია. ეს არის მყარი მაღალი დნობის წერტილებით. ძალიან მნიშვნელოვანია, რომ სილიციუმები არ მაღლა ტემპერატურის პირობებშიც კი. ამგვარად, მოლიბდენის საიდუმლოება MoSi 2 არ ცვლის 1600 ° C- ს, რაც საშუალებას იძლევა გამოიყენოს როგორც ელექტრო გამაცხელებელი გამათბობელი.
ლითონებზე დუმილის ფენის ჩამოყალიბება ფართოდ გამოიყენება სხვადასხვა ქიმიური რეაქციებში ჟანგვისა და კოროზიისგან. ბევრი silicides არიან ნახევარგამტარი.
SiH 4 silane, გათავისუფლებულია ჰიდროქლორიკის მჟავა ცივზე, არის შხამიანი გაზი უსიამოვნო სუნი. ეხება სილიციუმის ჰიდრაიდების ჯგუფს - სილიციუმის ნაერთებს წყალბადთან. სილიკონის წყალბადის მოლეკულები მსგავსია ჰიდროკარბონებისთვის. ოთახის ტემპერატურაზე, მონოცილინ SiH 4 და disilane Si 2 H 6 არის აირისებრი ნივთიერებები და დანარჩენი silanes, ბოლო ცნობილი Si 8 H 18, არის არასტაბილური სითხეები. ისინი შხამიანია და აქვთ უსიამოვნო სუნი. ქიმიურად ნაკლებად მდგრადია, ვიდრე ნახშირწყალბადები.
სილინის თვითმფრინავები:
SiH 4 2O 2 = SiO 2 2H 2 O
წყალი იხსნება silanes:
Si 2 H 6 4H 2 O = 2SiO 2 7H 2
SiH 4- ის ჩამოყალიბება და შემდგომი დაშლა გამოიყენება ნახევრად კონდიციონერების ინდუსტრიაში სუფთა სილიკონის მისაღებად.
განაცხადი
სილიკონტორად გამოიყენება სილიკონი. ე.წ. მზის ბატარეები მზადდება, რაც სინათლის ენერგიის ელექტროენერგიად გარდაქმნის (კოსმოსური რადიოსადგურების ენერგომომარაგება). სილიკონის გამოიყენება მეტალურგიის წარმოების სილიკონის steels მაღალი სითბოს წინააღმდეგობა და მჟავა წინააღმდეგობა.
^ 8.2. სილიკონის ოქსიდი (IV)
სილიკონის ოქსიდი (IV) (სილიკა) არის ყველაზე გავრცელებული ნაერთი ქერქში, რომელიც შედგება მისი მასის 12% სხვადასხვა მინერალების სახით. განასხვავებს კრისტალურ და ამორფულ სილიკას შორის.
1) ^ კრისტალური სილიკა - კვარცის მინერალისა და მისი ჯიშების სახით (როკ კრისტალი, ჩალცედენი, ალატი, იასპერი, ფლინტი); კვარცი ქმნის კვარცის ქვიშების საფუძველს ფართოდ გამოყენებული სამშენებლო და სილიკატური ინდუსტრიაში.
2) ^ ამორფული სილიკა - ოპალი მინერალური შემადგენლობის სახით SiO 2 nH 2 O; ამორფული სილიკის მიწიერ ფორმებს წარმოადგენს დიატომიტი, ტრიპოლი (ინფუზიური მიწა); ხელოვნური ამორფული უწყლო აბრეშუმის ნიმუშია სილიკომ-ის ნატრიუმი, რომელიც მიღებულია ნატრიუმის მეტაზილიკატისგან:
სილიკას გელი აქვს განვითარებულ ზედაპირს, რის გამოც იგი კარგად იტანს ტენიანობას.
კვარცი- ძალიან მძიმე, გამძლე, ცეცხლგამძლე ნივთიერება, დნობის წერტილი 1723 ° С. მყარი მასის სწრაფი გაგრილებისას კვარცის მინა იქმნება. მასში შესულია ლაბორატორიული მინის და სამეცნიერო კვლევების ინსტრუმენტები.
სილიკონის ოქსიდის (IV) მარტივი ფორმულაა SiO 2. ეს კრისტალს ატომურ ლატებში ატარებს. SiO 2- ის სტრუქტურაში პარალელურ გამოსახულებაში შეიძლება ჩამოყალიბდეს შემდეგი სახით:

თითოეული სილიკონის ატომი თან ერთვის 4 ჟანგბადის ატომს. ასეთ შემთხვევაში, სილიციუმის ატომი მდებარეობს ცენტრში და ჟანგბადის ატომები განლაგებულია ტეტრაჰედრონის ნიშნებით. მთელი ნაჭერი სილიკა შეიძლება ჩაითვალოს ბროლის სახით, რომლის ფორმულაც (Si0 2) n. სილიკონის ოქსიდის (IV) ასეთი სტრუქტურა იწვევს მის სიხშირეს და რეფრაქტორულობას.
ქიმიური თვისებები
წყალში, SiO 2 პრაქტიკულად შეუძლებელია. როგორც მჟავა ოქსიდი, ის რეაგირებს, როდესაც მყარი ალკალის, ძირითადი ოქსიდების და კარბონატების მდგრადია, რათა შეიქმნას სილიციუმის მჟავების მარილები:
SiO 2 2NaOH = Na 2 SiO 3 H 2 O
SiO 2 CaO = CaSiO 3
SiO 2 Na 2 CO 3 = Na 2 SiO 3 CO 2
მჟავა არ იმოქმედებს SiO 2- ზე. მხოლოდ hydrofluoric მჟავა თანდათან იხსნება:
SiO 2 4HF = SiF 4 2H 2 O
ეს რეაქციაა მინის ჭურჭლის საფუძველი. SiO 2- ის ნარევი 2000 ° C- მდე, ნახშირბადის კარბიდის SiC- ს ფორმირებაზე, რომელსაც ეწოდება carborundum: SiO 2 2C = SiC 2CO
განაცხადი
სილიკონის ოქსიდი (IV) ფართოდ გამოიყენება სილიკატის წარმოებაში მინის, კერამიკის, ბეტონის პროდუქტების, სილიკატური აგურის წარმოებაში. სუფთა კვარცი აუცილებელია ინსტრუმენტში. კვარცის კრისტალები არიან piezoelectric - მათ შეუძლიათ თითქმის გარეშე დაკარგვა გარდაქმნას ელექტროენერგიის შევიდა მექანიკური ენერგია. კვარცის მცირე კრისტალებიდან და პიუსელექტრული ფირფიტების წარმოქმნისგან კვარცი
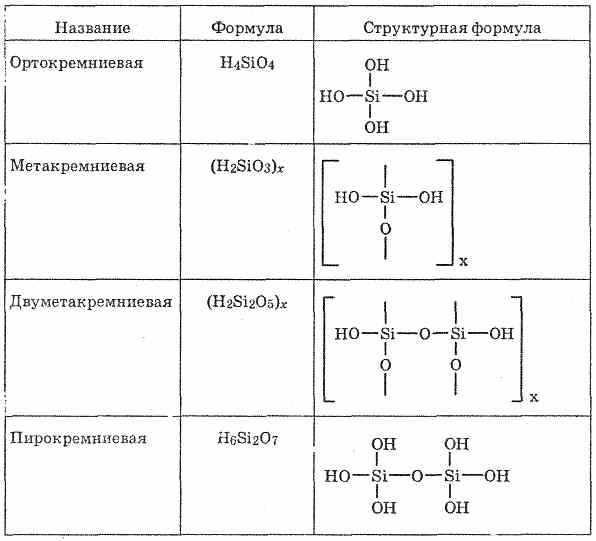
^ ცხრილი 26.
სილიციუმის მჟავა
შუშა ეს არის გამჭვირვალე არა მხოლოდ ხილული სინათლისთვის, არამედ ულტრაიისფერი, რომელსაც აქვს სამკურნალო ეფექტი.
^ 8.3. სილიციუმის მჟავები, სილიკატები
სილიციუმის მჟავები - სილიციუმის ოქსიდის (IV) ნაერთები წყლით, ძალიან სუსტი მჟავებით. სილიციუმის მჟავების SiO 2 და H 2 O- ის თანაფარდობა ძალიან განსხვავებულია, ამიტომ მათი შემადგენლობა ჩვეულებრივ წარმოადგენს ზოგად ფორმულას "SiO 2 mH 2 O. მჟავა სხვადასხვა n ადვილად გარდაქმნის ერთმანეთს. თავისუფალ მდგომარეობაში, ორთოზილიქსიური მჟავა H 4 SiO 4, მეტაცილინიმიური H 2 SiO 3 და რამდენიმე სხვა მჟავა იზოლირებული იყო (იხ. ცხრილი 26).
სილიციუმის მჟავა ირიბად მოქმედებენ მოქმედებებით. მჟავა კალიუმის ან ნატრიუმის სილიკატი:
Na 2 SiO 3 2HCl = 2NaCl H 2 SiO 3
სილიციუმის მჟავა ვერ მიიღება სუფთა სახით. წყალხსნარებში, იგი ქმნის კოლოიდურ გადაწყვეტას ან სოლს, რომელიც ძალიან მოკლე დროში არსებობს. მზე შემდგომი კოაგულატები და ლარი იქმნება. როდესაც გელი გამხმარი, პროდუქტების ფოროვანი სტრუქტურა ჩამოყალიბებულია - სილიციუმის ლარინები, რომლებიც გამოიყენება დეზიანტები და ადსორბენტები.
H 2 SiO 3 - მჟავა ძალიან სუსტი, ოდნავ ხსნადი წყალში. როდესაც მწვავე, იგი ადვილად decomposes მოსწონს carbonic მჟავა:
H 2 SiO 3 = H 2 O SiO 2
როგორც დიაბაზური მჟავა, ის განასხვავებს ნაბიჯებს:
H 2 SiO 3 H HSiO - 3
HSiO-3H SiO 2- 3
სილიციუმის მჟავა სუსტია, ვიდრე ნახშირი.
წყალხსნარებში, ნახშირბადის მჟავა სილიციუმისგან გამოყოფს მათ მარილებს:
Na 2 SiO 3 H 2 O CO 2 = Na 2 CO 3 H 2 SiO 3
სილიციუმის მჟავებს სილიკატები უწოდებენ. მათი შემადგენლობა ჩვეულებრივ წარმოდგენილია ფორმულით ელემენტების ოქსიდების ნაერთების სახით. მაგალითად, კალციუმის სილიკატი CaSiO 3 შეიძლება გამოხატავდეს: CaO SiO 2.
სილიკატები, როგორც წესი, წყალი არ არის. გამონაკლისი არის ნატრიუმის და კალიუმის სილიკატები, რომლებიც მიიღება SiO 2- თან შესაბამისი ჰიდროქსიდების ან კარბონატების გამოყენებით.
SiO 2 Na 2 CO 3 = CO 2 Na 2 SiO 3
ამ მარილების წყალხსნარულ ხსნარს ეწოდება "თხევადი მინა". ჰიდროლიზის შედეგად, "თხევად მინის" მკაცრი ალკოლოგიური რეაქციაა. " თხევადი მინა"გამოიყენება როგორც შემკვრელის მჟავა-რეზისტენტული ბეტონის წარმოებაში, ასევე საწარმოო წებოების დამზადების მიზნით. ისინი გაჟღენთილია ქსოვილის, ხის და ქაღალდის სახით ცეცხლის წინააღმდეგობის გაწევის და წყალგამძლეობის გაწევის მიზნით.
დედამიწის ქერქი შედგება სილიციუმის ოქსიდის (IV) და სხვადასხვა სილიკატებისგან. ბუნებრივი სილიკატები კომპლექსური შემადგენლობა და სტრუქტურაა. მაგალითად:
Feldspar K 2 O Al 2 O 3 6SiO 2 მაკა K 2 O 3Al 2 O 3 6SiO 2 2H 2 O ასბესტო 3MgO 2SiO 2 2H 2 O kaolin Al 2 O 3 2SiO 2 2H 2 O
ალმინალის შემცველი სილიკატები ეწოდება ალუმინოლიკალებს. ბუნებაში, ისინი ყველაზე გავრცელებული, როგორიცაა ფელდსპარები, ასევე სხვადასხვა სახის ნარევები
ნიხ სილიკატები. ასე რომ, კლდეები - გრანიტები და გნეები - შედგება კვარცის კრისტალები, ფელდსპარი და მიკა.
დედამიწის ზედაპირზე ქანების და მინერალების ტემპერატურის გავლენის ქვეშ და შემდეგ ნახშირორჟანგი გაქრება, ანუ, ნელა იშლება.
K 2 O 2 O 3 SiO 2 2H 2 O CO 2 Al 2 O 3 2SiO 2 2H 2 O K 2 CO 3 4SiO 2
განადგურების მთავარი პროდუქტი არის კაოლინიტის მინერალური - თეთრი თიხის ძირითადი კომპონენტი. ქანების გამოფიტვის შედეგად ჩამოყალიბდა თიხის, ქვიშისა და მარილების დეპოზიტები.
სილიკატების თვისებები განსხვავებულია მათი შემადგენლობისა და სტრუქტურის მიხედვით. ხშირად სილიკატები ქმნიან გამჭვირვალე და ძალიან ლამაზად ფერადი კრისტალებს; ზოგი მათგანი ძვირფას ქვები ძვირფასეულობებშია გამოყენებული (გნეტი, ტოპაზი, ზურმუხტი და ა.შ.). სიმკვრივის სიხშირე ჩვეულებრივ მერყეობს 2-დან 4 გ / სმ-მდე. სიბრმავე ზოგჯერ ძალიან მცირეა (მაგალითად, ტალკი), მაგრამ საკმაოდ მნიშვნელოვანია (მაგალითად, ცირკონი ZrSiO 4). როდესაც მწვავე silicates, ისინი ან დნება ან decompose მყარი სახელმწიფო. დნობის ქულები მერყეობს 750 დან 2000 ° C, ხოლო ზოგჯერ ისინი უფრო მაღალია.
ყველაზე მნიშვნელოვანია ხელოვნური სილიკატები, მინა, ცემენტი და კერამიკა.
ჩვეულებრივი ფანჯრის შუშის შემადგენლობა დაახლოებით გამოხატულია ფორმულა Na 2 O CaO 6SiO 2. მინის დამზადებულია სოდა Na 2 CO3, ცაცხვი CaCO 3 და თეთრი ქვიშა SiO 2 სპეციალური ღუმელების ნაზავი.
SiO 2 Na 2 CO 3 = Na 2 SiO 3 CO 2
SiO 2 CaCO 3 = CaSiO 3 CO 2
Na 2 SiO 3 CaSiO 3 4SiO 2 = Na 2 O CaO 6SiO 2
სპეციალური მინისთვის შეცვლის შემადგენლობა საწყისი ნარევი. შეცვალეთ სოდა Na 2 CO 3 potash K 2 CO 3, მიიღოს ცეცხლგამძლე მინის (ქიმიური ჭურჭელი). ცელქოზის CaCO 3- ის ცვლადი ოქსიდი (II) PbO და potash სოდა, მიიღე ბროლის მინა. მეტალის ოქსიდის დამატებით ლითონური ოქსიდი იძლევა სხვადასხვა ფერის: ქრომის (III) ოქსიდის Cr 2 O 3 - მწვანე, კობალტის (II) ოქსიდი CoO - ლურჯი, მანგანუმის (IV) ოქსიდი MnO 2 - მოწითალო-მეწამული და ა.შ.
გაზრდის ტემპერატურა, სათვალეები თანდათანობით არბილებენ და თხევად იქცევიან. საპირისპირო პროცესი ხორციელდება თანდათანობით - შუშის მასის სისქეზე, რადგან იგი ენერგია კლებულობს. მისგან მოძრავი მასზე დაფუძნებულია შუშის საკუთრებაზე.
სხვადასხვა პროდუქცია. დახმარებით მანქანები მინის მასა დახევის ფურცელი მინა.
ცემენტი
ჩვეულებრივი სილიკატური ცემენტი, ან პორტლანდ ცემენტი, არის მომწვანო ნაცრისფერი პუდრი, რომელიც, როდესაც შერეული წყლით, აძლიერებს ჰაერში (ან წყალში) ქვის მსგავსი მასით. ჩვეულებრივ, მოპოვების შედეგად (1400-1600 ° C) კირქვის და თიხის ნედლეულის ნარევი დამაბინძურებამდე.
გამკვრივების შემდეგ, ცემენტის, წყლისა და აგრეგატების (ქვიშის, ხრეში, დაფქული ქვა, წიდიანი) ნარევი აწარმოებს ხელოვნურ ქვას - ბეტონის. ბეტონის ფოლადის გაძლიერება ეწოდება რკინაბეტონის. კონცეპტები, რომელშიც ორგანული პოლიმერები ან პოლიმერები გამოიყენება, როგორც ცემენტის ერთად Binder ეწოდება პლასტიკური კონკრეტული.
კერამიკა
კერამიკა მოუწოდებს მასალებსა და სხვადასხვა პროდუქტებს, რომლებიც წარმოებულია ბუნებრივი თიხებით და მათი ნარევები მინერალური დანამატით, აგრეთვე ოქსიდები და სხვა არაორგანული ნაერთები, ჩამოსხმის, შემწვარი და საშრობი. ეს არის აგურის, ფილები, ფილები, მილები, ჭურჭელი, ფაიფური და ფაიერების პროდუქტი.
წარმოების მინის, ცემენტის და კერამიკის ეკუთვნის სილიკატური მრეწველობის, დამუშავების ბუნებრივი სილიციუმის ნაერთების.
კაცობრიობა სილიკონით გაეცნო ანტიკურში. ეს არის ამ ნივთიერება, რომ პრიმიტიული ხალხი თავისი იარაღები. და მოგვიანებით ეს იყო სილიკონის საფუძველზე, რომელმაც ხალხმა მინა გააკეთა. მიუხედავად იმისა, რომ სილიციუმის ნაერთები უკვე დიდი ხანია ცნობილია, სილიციუმი შედარებით ცოტა ხნის წინ იქნა მიღებული. დიდმა მეცნიერმა ბერზელმა 1823 წელს შეძლო სუფთა ამორფული სილიკონის მიღება, ხოლო 1854 წელს ა. კლერ ეშმაკმა მიიღო კრისტალური სილიკონი. თარგმანის ელემენტის სახელი ნიშნავს "მძიმე ქვას", რომელიც საკმაოდ სწორად ახასიათებს მას. ფიზიკური თვისებები.
ბუნებაში, სილიკონი არ არის ნაპოვნი მისი სუფთა სახით, ყველაზე ხშირად იგი წარმოდგენილია SiO 2 ოქსიდი, მინერალები ან მარილები სილიციუმის მჟავა.
განსაკუთრებით მნიშვნელოვანია სილიციუმის დაფუძნებული მინერალები. სილიციუმი არის ისეთი მინერალების, როგორიცაა ფლინტი, აზბესტის, ოტოკლაზას, ფელდარის, კვარცის და ბროლის საფუძველი. ეს მინერალები ქმნიან მთელს მთებს და მრავალრიცხოვანი ქვიშა არაფერს იშლება, არამედ კრაზს არაერთ ჭუჭყს. სილიკონი არ არის გავრცელებული ცხოველებისა და მცენარეთა. მისი რაოდენობა ცოცხალი ქსოვილებში მცირეა და ასაკთან ერთად მისი რაოდენობა მცირდება.
სილიკონი მოიპოვება ოქსიდის შემცირებაზე მაღალ ტემპერატურაზე:
SiO 2 + C = Si + 2CO
3SiO 2 + 4Al = 3Si + 2Al 2 O 3
ასევე, სილიკონის მიღება შესაძლებელია სილინის (წყალბადის ნაერთი სილიკონის)
სილიკონი ტიპიური არალითური ლითონია, მას აქვს თავისი ჯგუფის ყველა ტიპური თვისება.
1) ჟანგბადის ურთიერთქმედება
მიღებული სილიციუმის ოქსიდი 4 ინერტულია მისი თვისებები, ძნელია რეაგირება, მაგრამ აქტიურად რეაგირებს ჰიდროფუორიულ მჟავასთან:
4HF + SiO 2 = SiF 4 + 2H 2 O
2) ურთიერთქმედება ჰალოგენთან
ოთახის ტემპერატურაზე სილიციუმი რეაქციას იძლევა მხოლოდ ფლუორნით, როდესაც მწვავეა, ის რეაგირებს ქლორთან.
Si + 2Cl 2 = SiCl 4
3) ურთიერთქმედება ნახშირბადის
Si + C = Si +4 C-4
ამ რეაქციის შედეგად ნივთიერება მიიღება კარბორდუმამდე. მას გააჩნია უნიკალური ფიზიკური თვისებები: მისი ძალა ბრილიანტის მსგავსია.
კარბორანდუმში, ნახშირბადის ექსპოზიცია უარყოფითმა ჟანგვის მდგომარეობამ და სილიციუმმა, პოზიტიურმა, პერიოდული ცხრილის ამ ელემენტების პოზიციის გამო.

4) ურთიერთქმედება ლითონებთან
Si + 2Mg = Mg 2 Si
სი + 4Na = Na 4 Si
მიღებული ნივთიერებები ეწოდება სილიციდებს. როდესაც ძლიერი მჟავები მოქმედებს მათზე, საიუველირო გაზი გათავისუფლდება, რაც ქიმიური თვისებით მკაცრად ჰგავს ალკანებს, მაგრამ გაცილებით ნაკლებად სტაბილურია ხანგრძლივი ბონდის გამო.
5) ოქსიდების აღდგენა
ერთად ამაღლებული ტემპერატურა სილიკონის შეძენა შეუძლია ბევრი ლითონების მათი ოქსიდები.
2CuO + Si = SiO 2 + 2Cu
6) ურთიერთქმედება ალკალისთან
ამაღლებული ტემპერატურის დროს, სილიციუმი რეაგირებს ტუტე გადაწყვეტილებებთან.
Si + 2NaOH + H 2 O = Na 2 SiO 3 + 2H 2 (ნატრიუმის მეტაქსილატი)
Si + 4NaOH = Na 4 SiO 3 + 2H 2 (ნატრიუმის orthoxylate)
თვისებები
14 სი.|
ატომური მასა |
კლარკი, ზე. (ბუნების გავრცელების) |
||
|
ელექტრონული კონფიგურაცია * |
აგრეგაციის სახელმწიფო |
მყარი |
|
|
მუქი ნაცრისფერი მბზინავი |
|||
|
იონიზაციის ენერგია
|
|||
|
შედარებითი ელექტრო-ნეგატიურობა |
სიმჭიდროვე |
||
|
შესაძლო ჟანგვის მიხედვით |
სტანდარტული ელექტროდი პოტენციალი |
* ელემენტის ატომის გარე ელექტრონული დონის კონფიგურაცია. დანარჩენი ელექტრონული დონის კონფიგურაცია ემთხვევა კეთილშობილ გაზს, რომელიც წინა პერიოდის დასრულებას და ფრჩხილებში მითითებულია.
ბუნებაში ყოფნა.
სილიკონის შემდეგ ჟანგბადი ყველაზე გავრცელებული ელემენტია ქერქში. ნახშირბადისგან განსხვავებით თავისუფალი სახელმწიფო, სილიკონი არ არის ბუნებაში. მისი ყველაზე გავრცელებული ნაერთებია სილიციუმის ოქსიდი (IV) SiO 2 და სილიციუმის მჟავა მარილები - სილიკატები. ისინი ქმნიან დედამიწის ქერქის ჭურვი. სილიკონის ნაერთები გვხვდება მცენარეებსა და ცხოველებში.ბუნებრივი სილიკატები კომპლექსური შემადგენლობა და სტრუქტურაა. აქ არის გარკვეული ბუნებრივი სილიკატების შემადგენლობა: ფელდსპარ კ
2 o × Al 2 O 3 × 6SiO 2, აზბესტის 3 მგ ო × 2SiO 2 × 2H 2 O, გხალხი K 2 O × 3 l 2 O 3 × 6SiO 2 × 2H 2 O,kaolinite 3 l 2 O 3 × 2SiO 2 × 2H 2 O.ასევე ითვლება სილიკატები, რომლებიც შეიცავს ალუმინას ალუმინოლიკატები. ზემოხსენებული სილიკატებიდან, ალუმონილიკატები არიან ფელდსპარი, კაოლინი და მიკა. ბუნებაში, ალუმონილიკატები, როგორიცაა ფელდსპარები, ყველაზე გავრცელებული. ასევე არსებობს სხვადასხვა სილიკატების ნარევები. ასე რომ, კლდეები - გრანიტი და გნეზი - შედგება კვარცის კრისტალებითაგან, ფელდსპარისა და მაკისგან.
.განადგურების მთავარი პროდუქტი არის კაოლინიტის მინერალური - თეთრი თიხის ძირითადი კომპონენტი. ქანების გამოფიტვის შედეგად ჩამოყალიბდა თიხის, ქვიშისა და მარილების დეპოზიტები.
მიღება. სილიკონის წარმოება მზადდება აღდგენით
SiO 2 კოქსის ელექტრო ღუმელებში:ლაბორატორიაში, როგორც შემცირების აგენტი მაგნიუმის ან ალუმინის გამოყენებით:
ყველაზე სუფთა სილიკონი მიიღება სილიკონის ტეტრაქლორიდის შემცირებით, თუთიის ორთქლით:
განაცხადი.
სილიკონტორად გამოიყენება სილიკონი. ე.წ. მზისგან დამზადებული უჯრედები მზადდება, რომლებიც სინათლის ენერგეტიკას ელექტრო ენერგიად გარდაქმნის (კოსმოსური რადიოსადგურების ენერგომომარაგება). სილიკონის გამოიყენება მეტალურგიის წარმოების სილიკონის steels მაღალი სითბოს წინააღმდეგობა და მჟავა წინააღმდეგობა.ფიზიკური თვისებები. კრისტალური სილიციუმი არის მუქი ნაცრისფერი ნივთიერება ფოლადი ლურსმნებით. სილიკონის სტრუქტურა ალმასის სტრუქტურის მსგავსია. მისი ბროლის, თითოეული ატომი აკრავს ტეტრაჰტრალური ოთხი სხვა და უკავშირდება მათ კოვალენტური ობლიგაციით, რომელიც გაცილებით სუსტია, ვიდრე ალმასის ნახშირბადის ატომებს შორის. სილიკონის კრისტალში, ნორმალურ პირობებშიც კი, ზოგიერთი კოვალენტური ობლიგაციები განადგურებულია. აქედან გამომდინარე, მას აქვს თავისუფალი ელექტრონები, რამაც მცირე ელექტროგამტარობა გამოიწვია. როდესაც განათება და გათბობა ზრდის გატეხილი ობლიგაციების რაოდენობას, რაც იმას ნიშნავს, რომ თავისუფალი ელექტრონების რიცხვი იზრდება და ელექტროგამტარობა იზრდება. ასე რომ, აუხსენით, რომ სილიკონის ნახევარგამტარული თვისებებია.
სილიკონი ძალიან მყიფეა, მისი სიმჭიდროვეა 2.33 გ / სმ 3 . ნახშირის მსგავსად, ეხება ცეცხლგამძლე ნივთიერებებს.
სილიკონის შედგება სამი სტაბილური იზოტოპები: 28 14 Si (92.27%), 29 14 Si (4.68%) და 30 14 სმე (3.05%).
ქიმიური თვისებები
ქიმიური თვისებებით, სილიკონი, ნახშირბადის მსგავსად, არ არის ლითონი, მაგრამ მისი არალითალურობა ნაკლებად გამოხატულია, რადგან მას უფრო დიდი ატომური რადიუსი გააჩნია. მას შემდეგ, რაც სილიციუმის ატომები გარე ენერგეტიკულ დონეზე 4 ელექტრონს იძლევა, ორივე -4 და +4- ის ჟანგვის მდგომარეობა სილიკონის დამახასიათებელია (სილიციუმის ნაერთი ცნობილია, სადაც მისი ხარისხი ოქსიდაციულია +2).სილიკონი ნორმალურ პირობებში საკმაოდ ინერტულია, რომელიც უნდა აიხსნას მისი ბროლის ფარდის სიძლიერით. უშუალოდ ის ხსნის მხოლოდ ფტორს:
![]()
მჟავა (გარდა ჰიდროფუორიური ნარევი
HF და აზოტის HNO 3 ა) არ მოქმედებს სილიციუმზე. თუმცა, ის იხსნება ტუტე მეტალთა ჰიდროქსიდში, რომელიც ქმნის სილიკატს და წყალბადს:სილიციუმის, კრისტალური და ამორფული, ამორფული სილიციუმის ორი ალტოტროპული მოდიფიკაცია უფრო ქიმიურად აქტიურია. ის რეაქციას იწვევს ჟანგბადზე, როდესაც შეიწოვება
SiO 2:![]()
და ასევე ყველა ჰალოგენთან ერთად, მაგალითად:
![]()
მაღალ ტემპერატურაზე, სილიკონი აერთიანებს ნახშირბადის წარმოქმნას carborundum
SiC:![]()
კარბორუმუმს აქვს ალმასის მსგავსი ბროლის ლაიტი, რომელშიც თითოეული სილიკონის ატომი აკრავს 4 ნახშირბადის ატომს და პირიქით, და კოვალენტური ობლიგაციები ძალიან ძლიერია, როგორც ალმასი. აქედან გამომდინარე, სიბნელეში არის ალმასთან ახლოს. Grinding ქვები და სახეხი ბორბლები მზადდება სილიკონის კარბიდიდან.
მაგნიუმის სირბილი. აქტიური ლითონებთან რეაქციაში წარმოიქმნება ფორმირება სილიციდები, სილიკონი მოქმედებს, როგორც ჟანგვითი აგენტი:
![]()
მაღალ ტემპერატურაზე, სილიციუმი ბევრმა ლითონს აღწევს მათი ოქსიდან.
Silane სილიციუმზე ჰიდროქლორინის მჟავების მოქმედებით სილიციუმის მარტივი წყალბადის ნაერთია silane
SiH 4: - შხამიანი გაზი უსიამოვნო სუნი, თვითმფრინავი ჰაერში:სილიკონის ოქსიდი
(ივ)სილიკონის ოქსიდის (IV) ასევე მოუწოდა silica. ეს არის მყარი ცეცხლგამძლე ნივთიერება.(დნობის წერტილი 1700 ° C), გავრცელებული ბუნებაში ორიტიპები: 1) კრისტალური სილიკა - კვარცის მინერალისა და მისი ჯიშების სახით (როკ კრისტალი, ჩალცედენი, ალატი, იასპერი, ფლინტი); კვარცი ქმნის კვარცის ქვიშების საფუძველს ფართოდ გამოყენებული სამშენებლო და სილიკატური ინდუსტრიაში; 2) ამორფული სილიკა - ოპალი მინერალური შემადგენლობის სახით SiO 2 × n H 2 ო; ამორფული სილიკის მიწიერ ფორმებს წარმოადგენს დიატომიტი, ტრიპოლი (ინფუზიური მიწა); ხელოვნური ამორფული უწყლო აბრეშუმის ნიმუშია სილიკომ-ის ნატრიუმი, რომელიც მიღებულია ნატრიუმის მეტაზილიკატისგან:
სილიკომას აქვს მკაფიო ზედაპირი, ამიტომ კარგად შეიწოვება ტენიანობა.
ზე 1710 ° კვარცის დნება. მყარი მასის სწრაფი გაგრილებით
კვარცის მინა იქმნება. მას აქვს ძალიან დაბალი კოეფიციენტი გაფართოების, ისე, რომ ცხელი კვარცი მინის არ ბზარი, როდესაც წყალი სწრაფად გაცივდა. ლაბორატორიული მინის და სამეცნიერო კვლევების ინსტრუმენტები კვარცის მინისგან შედგება.სილიკონის ოქსიდის (IV) მარტივი ფორმულა SO 2 მსგავსი ნახშირბადის მონოქსიდის ფორმულა (IV) CO 2 . იმავდროულად, მათი ფიზიკური თვისებები ძალიან განსხვავებულია (SiO 2 - მყარი CO 2 - გაზი). ეს განსხვავებაა ბროლის ლატის სტრუქტურის გამო. C0 2 კრისტალიზებულია მოლეკულურ ლატებში, SiO 2 - ატომურში. სტრუქტურაSiO 2 პარალელურ გამოსახულებაში შეიძლება წარმოდგენილი იყოს: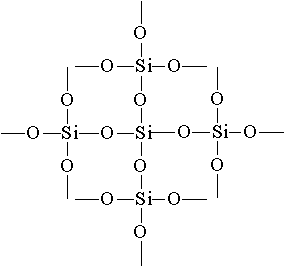
ნახშირბადის ატომების კოორდინაციის რაოდენობა მდ
O 2 ტოლია 2 და სილიკონი SiO 2 4. თითოეული სილიკონის ატომი თან ერთვის 4 ჟანგბადის ატომს. ამ შემთხვევაში, სილიციუმის ატომი მდებარეობს ცენტრში და ჟანგბადის ატომები განლაგებულია ტეტრაჰედრონის დაპყრობაზე. მთელი ნაჭერი სილიკა შეიძლება ჩაითვალოს ბროლის სახით, რომლის ფორმულაც (SiO 2) n. სილიკონის ოქსიდის (IV) ასეთ სტრუქტურას განსაზღვრავს მისი მაღალი სიმტკიცე და რეფრაქტორულობა.სილიკონის ოქსიდის (IV) ქიმიური თვისებები
SiO 2 ეხება მჟავა ოქსიდები. მყარი ალკალის შემთხვევაში, ძირითადი ოქსიდები და კარბონატები, სილიციუმის მჟავები იქმნება: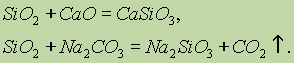
მხოლოდ ჰიდროფუორიული მჟავა იწვევს სილიციუმის ოქსიდს (IV):
ამ რეაქციასთან ერთად, მინის არის დახრილი.
სილიკონი (IV) ოქსიდი არ იშლება წყალში და არ აქვს ქიმიურად ურთიერთქმედება. აქედან გამომდინარე, სილიციუმის მჟავა ირიბად იღებს კალიუმის ან ნატრიუმის სილიკატის გადაწყვეტისას მჟავით მოქმედებას:
ამ შემთხვევაში, სილიციუმის მჟავა
(დამოკიდებულია მარილისა და მჟავის თავდაპირველი გადაწყვეტილებების კონცენტრაციაზე) მიღება როგორც გლეტინის მასა შემცველი წყლის სახით, ასევე კოლოიდური ხსნარის სახით.სილიციუმის მჟავა.
SiO 2 არის რიგი სილიციუმის მჟავების ანჰიდრიდი, რომლის შემადგენლობა შეიძლება გამოიხატოს საერთო ფორმულით xSiO 2 × yH 2 O, სადაც x და y - რიცხვები: = 1, y = 1: SiO 2 × H 2 O, i.e. H 2 SiO 3 - მეტაბილური მჟავა;2) x = 1, y = 2: SiO 2 × 2H 2 O, i.e. H 4 SiO 4 - orthosilicic მჟავა;
x = 2, y = 1: 2SiO 2 × H 2 O, i.e. H 2 Si 2 O 5 - bimetacrynic მჟავა. სილიციუმის მჟავა აწარმოებს ტეტრაჰტრალური სტრუქტურული ერთეულებისგან (თითოეულ ასეთ ერთეულში, სილიციუმის ატომია ტეტრაჰედრონის ცენტრში და არსებობს ატმოსფეროში ჟანგბადის ატომები). სტრუქტურული კავშირები, გაერთიანების ჯაჭვებში, უფრო სტაბილური პოლიციილიონის მჟავების ჩამოყალიბება:
ასეთი ნაერთების შემადგენლობა ფორმულაზე შეიძლება გამოიხატოს
(H 2 SiO 3) n. თუმცა, როგორც წესი, სილიციუმის მჟავა წარმოდგენილია ფორმულით H 2 SiO 3. H 2 SiO 3 - მჟავა ძალიან სუსტი, ოდნავ ხსნადი წყალში. როდესაც მწვავე ადვილად შეიწოვება კარბონატული მჟავას:ყველა სილიციუმის მჟავა ძალიან სუსტი (სუსტია, ვიდრე ნახშირი).
სილიკატები.
მარილები ყველა სილიციუმის მჟავებს უწოდებენ სილიკატები, თუმცა, როგორც წესი, საგანმანათლებლო ლიტერატურაში, სილიკატები გულისხმობენ მეტა-სილიციუმის მჟავას მარილებს. მათი შემადგენლობა ჩვეულებრივ წარმოდგენილია ფორმულით ელემენტების ოქსიდების ნაერთების სახით. მაგალითად, კალციუმის სილიკატი CaSiO 3 შეიძლება გამოიხატოს როგორც: Cao ×SiO 2.სილიკატების შემადგენლობა
რ 2 ო × nSiO 2, სადაც R 2 O - ნატრიუმის ან კალიუმის ოქსიდები ეწოდება ხსნადი მინა და მათი კონცენტრირებული წყალხსნარ - თხევადი მინა. ყველაზე მნიშვნელოვანია ნატრიუმის ხსნადი მინა.ჰაერში მყოფი სილიკატების გამოსხივება ზრდის ტურბინს, ვინაიდან ჰაერში ნახშირორჟანგი (IV) ჰაერში სილიციუმის მჟავას მისი მარილებისგან აფერხებს:
სილიციუმის მჟავა პრაქტიკულად შეუძლებელია წყალში - ეს ქონება იონისთვის ხარისხობრივი რეაქციისთვის გამოიყენება
სიო 3 2 - .სილიკატები მიიღება სილიკის მიერ ალკალის ან კარბონატების გამოყენებით.
სილიკატების გამოყენება.
ყველაზე ფართოდ გამოიყენება სილიკატები ნატრიუმის და კალიუმის. ამ მარილების კონცენტრირებული გადაწყვეტილებები ეწოდება თხევადი მინა; ჰიდროლიზის გამო მათ აქვთ მკაცრად ტუტე რეაქცია. თხევადი მინის გამოიყენება წებო და წყალგაუმტარი ქსოვილების წარმოებაში. თხევადი მინა გამოიყენება როგორც მწვავე მჟავა მდგრადი კორექციის წარმოებაში, აგრეთვე საწარმოო წებოების დამზადების მიზნით. ისინი გაჟღენთილია ქსოვილის, ხის და ქაღალდის სახით ცეცხლის წინააღმდეგობის გაწევის და წყალგამძლეობის გაწევის მიზნით.Copyright © 2005-2013 Xenoid v2.0
შესაძლებელია მასალების გამოყენება, თუ მითითებულია აქტიური ბმული.
| მსგავსი სტატიები: | |
|
რატომ არის სისხლის წნევის მკვეთრი ზრდა?
მაღალი არტერიული წნევის ყველაზე თვალსაჩინო ნიშნებია თავის ტკივილი, ... წონა კვლავ დგას - რა უნდა გააკეთოს წონაში, როგორ ჩამოყალიბდეს
ხანგრძლივი წონის დაკარგვის დროს, თითქმის ყველას აქვს პრობლემა ... გზა Bitcoin რამაც მანქანა
VkontakteOdnoklassniki დღეს Bitcoins (ფულის ელექტრონული გადახდა ... | |