O'quvchining tanlovi
Ommabop maqolalar
Kirish
Sizning kvartirangiz yangilandi va keramik plitkalar sotib olishingiz kerak. Do'konda, turli shakllar va ranglarni uzoq vaqt davomida ajratib turganda, siz to'g'ri topdingiz va kassaga chiqdingiz, uning tarkibiy qismini yozgan kafel bilan paketning bir qismini ko'rib qoldingiz. Deyarli barcha moddalar taniqli, ammo ulardan biri sizni hayratda qoldirdi - silikon oksidi. Tabiiyki, siz u haqida ko'proq bilishni xohlaysiz. Bugun men sizning qiziqishingizni qondirishga harakat qilaman.
Ta'rif
Silikon o'zgarmaydigan valentga ega va shuning uchun kimyoda kislorod bilan ikkita birikmasi ma'lum. Bugungi kunda biz yuqori silika bilan qaraymiz, unda IV ning Valantsiyasi mavjud.
Ism
Turli manbalarda u silika dioksidi, silika yoki silika deb ataladi.
Xususiyatlar
Bu kislotali oksid bo'lib, u qattiq va mustahkamdir. Agar u qizdirilsa va har qanday gidroksidi / asosiy oksid bo'lsa, ular bir-biri bilan ta'sir o'tkazadi. Ushbu silikon bileşiği, bir shisha oldingi, ya'ni super - soğutulmuş eritmalar oynasiga olib kelishi mumkin.  Bundan tashqari (uning sof shaklida) elektr tokidan o'tmaydi (dielektrikdir). Silikon oksidi atomik kristalli panjaraga ega. U kislotalarga chidamli bo'ladi, lekin istisno hidroflorik va gazli vodorodli florid. Reaktsiya mahsulotlari ikkilamchi silikon florid va suvdir. Agar ikkinchi reaktiv vodorodli florid eritmasi bo'lsa, unda uning mahsulotlari heksafluorosilik kislota va bir xil suv bo'ladi. Agar biron-bir faol metallning gidroksidi / asosiy oksidi / karbonat bilan loyqalangan silikon (IV) bo'lsa, reaksiya mahsuloti faqat kaliy va natriy silikatlari eriydigan silikat tuzi - silikat bo'ladi. Keyinchalik suyuqliklarning o'zaro ta'sirining mahsulotlari suyuq shisha deb ataladi. Ular kuchli gidroksidi muhitga ega, buning sababi - bu gidroliz. Gidrolize qilingan silikatlar to'g'ri emas, balki kolloid eritmalarni hosil qiladi. Agar kaliy yoki natriy silikat eritmalari ozgina oksidlansa, hidli kremniy kislotadan iborat bo'lgan jelatinli oq cho'kma paydo bo'ladi.
Bundan tashqari (uning sof shaklida) elektr tokidan o'tmaydi (dielektrikdir). Silikon oksidi atomik kristalli panjaraga ega. U kislotalarga chidamli bo'ladi, lekin istisno hidroflorik va gazli vodorodli florid. Reaktsiya mahsulotlari ikkilamchi silikon florid va suvdir. Agar ikkinchi reaktiv vodorodli florid eritmasi bo'lsa, unda uning mahsulotlari heksafluorosilik kislota va bir xil suv bo'ladi. Agar biron-bir faol metallning gidroksidi / asosiy oksidi / karbonat bilan loyqalangan silikon (IV) bo'lsa, reaksiya mahsuloti faqat kaliy va natriy silikatlari eriydigan silikat tuzi - silikat bo'ladi. Keyinchalik suyuqliklarning o'zaro ta'sirining mahsulotlari suyuq shisha deb ataladi. Ular kuchli gidroksidi muhitga ega, buning sababi - bu gidroliz. Gidrolize qilingan silikatlar to'g'ri emas, balki kolloid eritmalarni hosil qiladi. Agar kaliy yoki natriy silikat eritmalari ozgina oksidlansa, hidli kremniy kislotadan iborat bo'lgan jelatinli oq cho'kma paydo bo'ladi.
Ishga kirishish
Sanoatda silikon oksidi kislorod muhitida kremniyni isitish yo'li bilan olinadi. U oksidlanib, kerakli mahsulotni hosil qiladi. Bundan tashqari, u termal oksidlanish bilan ham qazib olinadi. Laboratoriyada silikon oksidi eruvchan silikat ustida har qanday kislotaning ta'siri bilan olinadi, bunga hatto kuchsiz sirka kislotasi ham mos keladi. Misol uchun, agar uni natriy silikat bilan birlashtiradigan bo'lsangiz, reaksiya mahsuloti natriy asetat va kremik kislota bo'ladi. Ularning parchalanishi zudlik bilan amalga oshiriladi va uning parchalanishi mahsuloti suv va kerakli oksid bo'ladi.
 Dastur
Dastur
Silikon oksidi, shisha, seramika, abraziv materiallar, beton mahsulotlari ishlab chiqariladi va silikonning o'zi ishlab chiqariladi. U kauchuk sanoatida to'ldiruvchi sifatida xizmat qiladi. Kremniy oksidi - kvarts shishasining amorf modifikatsiyasining kristallari piezoelektrik xususiyatlarga ega bo'lib, radiotexnika, ultratovush tizimlari va yoritgichlar yaratuvchilaridan foydalanadi. Silikatlar va silikatlar - litosferaning massasining qariyb 90%. Silikon oksidi E551 oziq-ovqat moddasi sifatida ham tanilgan. Bu uning amorf bo'lmagan gözeneksiz turi. Ovqatlanishni oldini olish va oziq-ovqat mahsulotlarini to'plashni oldini oladi, dori-darmonlarga yordamchi moddalar va enterosorbent dori sifatida qo'llaniladi. Ushbu oksidli filmlar mikrochiplar va boshqa elektron komponentlar ishlab chiqarilganda izolyator sifatida xizmat qiladi. Ular shuningdek optik tolali kabellarni ham yaratadilar. Elektron sigaraning isitish elementlari silika ipsiz holda amalga oshirilishi mumkin emas edi.
Xulosa
Bu oksidning qanchalik keng tarqalganligi shu. Va buni ko'rish uchun siz tsement va betonni ko'rib chiqish uchun do'konga va qiziqishga qochishingiz shart emas. Tabiiy kremniy oyoqlarimiz ostidadir - bu oddiy qumdir. Bu foydali bo'lishi mumkin.
Silikon. Atomning tuzilishi, kristalli silikon, uning xususiyatlari va ilovalari. Silikon oksidi (IV), uning tabiiy navlari. Silikatlar. Jonli va jonsiz tabiatdagi silikon birikmalarining qiymati. Silikat sanoati tushunchasi.
Mavzu: Silikon. Atomning tuzilishi, kristalli silikon, uning xususiyatlari va ilovalari. Silikon oksidi (IV), uning tabiiy navlari. Silikatlar. Jonli va jonsiz tabiatdagi silikon birikmalarining qiymati. Silikat sanoati tushunchasi.
Reja
1. Atom tuzilishi
2. Kremniyning fizikaviy va kimyoviy xossalari.
3. Silisik kislota olish.
4. Silikatlar. Qurilish mollari.
Adabiyot:
Silikon 1823 yilda Shvetsiyalik kimyogar Jens Yakob Berzelius tomonidan topilgan va olingan. Yer qobig'idagi kisloroddan keyingi ikkinchi element (og'irligi 27,6%). Birlashmalarda topilgan.
Yerosti holatidagi kremniy atomining tuzilishi:
1s 2 2s 2 2p 6 3s 2 3p 2
Qiziqarli holatdagi kremniy atomining tuzilishi:
1s 2 2s 2 2p 6 3s 1 3p 3
Kristalli silikon - metall yorqinlikka ega bo'lgan quyuq kulrang material, qattiq qattiqlik, qattiq, yarim o'tkazgich; R = 2,33 g / sm3 , t ° pl. = 1415 ° S; t ° kip = 2680 ° S Olmosga o'xshash tuzilishga ega va kuchli kovalent birikmalar hosil qiladi. Ishsizlik.
Amorf silikon- jigarrang toza, higroskopik, olmosga o'xshash struktura, p = 2 g / sm3 ko'proq reaktiv.
Silikon olish
Sanoatda - qum bilan ko'mirni isitish:
2C + SiO 2 t˚ → Si + 2CO
Laboratoriyada - qum magniy bilan isitiladi :
2Mg + SiO 2 ta → Si + 2MgO
Kimyoviy xossalari
Odatda metall bo'lmagan, inert.
Kamaytirish vositasi sifatida:
Si 0 + O 2 t˚ → Si + 4 O 2
Si 0 + 2F 2 → SiF 4
Si 0 + C t˚ → Si +4 S
(SiC - karborund - qattiq, nuqta öğütme uchun ishlatiladi;)
Silan (SiH 4 ) metall silikat kislotasining parchalanishiga yo'l qo'yiladi.
Mg 2 Si + 2H 2SO 4 → SiH 4 + 2MgSO 4
3Si + 4HNO 3 + 18HF → 3H 2 + 4NO + 8H 2 O
Oksidlovchi sifatida:
Si 0 + 2Mg t ° → Mg 2 Si -4
Silikon ilovasi:
Silikon elektronikada yarimo'tkazgich sifatida keng qo'llaniladi. Silikonning qotishmalarga qo'shilishi ularning korroziyaga chidamliligini oshiradi. Silikatlar, aluminosilikatlar va silika - shisha va seramika ishlab chiqarish uchun asosiy xomashyo, shuningdek, qurilish sanoati uchun.
Silan - SiH 4
Jismoniy xususiyatlar: Rangsiz gaz, zaharli, t ° pl. = -185 ° S, t ° kip. = -112 ° S
Ishga kirishish : Mg 2 Si + 4HCI → 2MgCl 2 + SiH 4
Kimyoviy xossalari:
Silikon oksid (IV) - (SiO2) n
SiO 2 - kvarts, rinoston, ametist
,
agat, jasper, opal
, silika (qumning asosiy qismi). Silikon oksidning (IV) kristall panjarasi atom bo'lib, quyidagi strukturaga ega: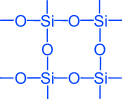

Al 2 O 3 2SiO 2 2H 2 O - kaolinit (loyning asosiy qismi)
K 2 O Al 2 O 3 6SiO 2 - ortoklaz (dala shpati)
Jismoniy xususiyatlar:Qattiq, kristalli, refrakter moddalar, t ° pl = 1728 ° S, t ° kip. = 2590 ° S
Kimyoviy xossalari:
Kislota oksidi. Fulyatsiya asosiy oksidlar, alkaliler, shuningdek gidroksidi va gidroksidi tuproq metallar bilan karbonatlar bilan ta'sir o'tkazadi.
SiO 2 + CaO t ° → CaSiO 3
SiO2 + 2NaOH t3 → Na 2 SiO 3 + H 2 O
SiO 2 + CaCO 3 taym → CaSiO 3 + CO 2
SiO 2 + K 2 CO 3 t ° → K 2 SiO 3 + CO 2
SiO 2 + 4HF t˚ → SiF 4 + 2H 2 O
SiO 2 + 6HF t → H 2 (heksafluorosilik kislota) + 2H 2 O)
(oynalar shishishi bilan bog'liq reaktsiyalar).
Ilova:
2. Silisik kislota olish.
x SiO 2 y H 2 O 
x = 1, y = 1 H 2 SiO 3 - metasilik kislotasi
x = 1, y = 2H 4 SiO 4 - ortosilik kislota va boshqalar.
Jismoniy xususiyatlar: H 2 SiO 3 - juda zaif (ko'mirdan zaif), nozik, suvda bir oz eriydi (kolloid eritma hosil qiladi), nordon ta'mga ega emas.
Qabul qilish:
Kuchli kislotalarni silikatlarga ta'siri - Na2 SiO 3 + 2HCl → 2NaCl + H 2 SiO 3 ↓
(silika jelini olish, silika kislotasini olish)
Kimyoviy xossalari:
Silikat kislota tuzlari deyiladi -silikatlar.
Na 2 SiO 3 + H 2 O + CO 2 = Na 2 CO 3 + H 2 SiO 3
Na 2 SiO 3 + CaCl 2 = 2NaCl + CaSiO 3 ↓
(K 2 O Al 2 O 3 6SiO 2) (feldispat) + CO 2 + 2H 2 O → (Al 2 O 3 2SiO 2 2H 2 O) (kaolinit (gil)) + 4SiO2 (silika (qum)) + K2 CO 3
Kaliy silikat eritmasi bilan tajriba trubkasida suyultirilgan xlorid kislotasini eritmasini qo'shing. In vitro silikik kislotada oq yarim qattiq massa hosil bo'ladi.
Na 2 SiO 3 + HCl = 2NaCl + H 2 SiO 3 
Kremniy birikmalaridan foydalanish
Tabiiy silikon birikmalari - qum (SiO2 ) va silikatlar seramika, shisha va tsement ishlab chiqarishda qo'llaniladi.
Oddiy oyna oynasining tarkibi taxminan Na2O CaO 6 SIO formulasi bilan ifodalanadi2 . Shisha, Na soda aralashmasini maxsus o'choqlarga to'ldirish orqali ishlab chiqariladi.2 CO 3 ohaktosh kazoni3 va oq qum SIO2.
3. Silikatlar. Qurilish mollari.

Kulolchilik |
|
Chinni = kaolin + gil + kvarts + feldspar. Vatan chinni - Xitoyda, chinni 220g da allaqachon ma'lum. 1746 yilda Rossiyada chinni ishlab chiqarildi
| Fayans - italiya Fenza shahri nomidan. XIV va X asrlarda seramika hunarmandchiligi yaratilgan. Fayans - yuqori miqdorda loydan (85%) chinnidan, past haroratdan farq qiladi.
|
Shisha, shifo bergan har qanday shaklni yumshata oladigan va qabul qiladigan nozik, shaffof materialdir. Shisha ovqat pishiriladi partiya (qum, soda va ohaktoshdan tashkil topgan xom aralash) maxsus oyna eritadigan pechlarda.


Zaryadni eritish paytida yuz beradigan asosiy reaktsiyalar
Na 2 CO 3 + SiO 2 = Na 2 SiO 3 + CO 2
2. CaCO 3 + SiO 2 = CaSiO 3 + CO 2
Na 2 SiO 3 + CaSiO 3 + 4SiO 2 = Na 2 O * CaO * 6SiO 2 - oyna oyna formulasi
R silikatlar2 nSiO 2 haqida, R 2 O - natriy yoki kaliy oksidi, eruvchan shisha deb ataladi va ularning konsentrlangan eritmalari - suyuq shisha.
Ko'pincha shisha ishlab chiqarishda soda natriy sulfat va ko'mir bilan almashtiriladi. Bu holda natriy silikat reaktsiya tenglamasi bilan hosil bo'ladi:
Qo'rg'oshin oksidi qo'shilganda, kristal hosil bo'ladi. Maxsus oyna ishlab chiqarish uchun dastlabki aralashmaning tarkibini o'zgartiring. Na soda almashtirish2 CO 3 ga biz K 2 CO 3 kaliyini topamiz , refrakter shisha (kimyoviy shisha uchun) olish. Metan oksidi qo'shimchalari chiqish aralashmasiga shisha rangini beradi: xrom oksidi - (III) Cr2 o 3 , Yashil, kobalt (II) oksidi KoO - ko'k, marganets (IV) oksid MpO2 - qizil - liburchak.
Tsement 

Muntazam silikat tsement - suv bilan aralashtirilganda, toshga o'xshash massaga aylanadigan, havo bilan (yoki suvda) qattiqlashadigan yashil-kulrang kukun. Odatda ohaktosh va loydan tarkib topgan xom aralashmani sinterlash uchun kalsinlanish (1400-1600 ° S) bilan olinadi. Kalsinatsiya maxsus silindrsimon qaytib o'choqlarda amalga oshiriladi.Klinker - Qora rangli kulrang rangli to'playdi maxsus qaytib o'choqlarda loy va ohaktoshni sinterlash orqali olinadi. Aralashmaning tarkibini sozlash bilan, oling turli xil turlari tsement - tez qattiqlashuvchi, sovuqqa chidamli, korroziyaga chidamli. Tsement, suv va plomba moddalarining aralashmasidan (qum, shag'al, ezilgan tosh, cüruf) ularning qattiqlashuvidan so'ng beton - sun'iy tosh olinadi. Ushbu materiallarning qattiqlashishga aralashmasi beton aralashmasi deb ataladi. Qattiqlashtirilganda, tsement solingan to'ldiruvchilarning tanasini bog'laydi. Sertleşme suv ichida ham sodir bo'ladi. Po'latni mustahkamlovchi beton (ichki ramka) temir-beton deb ataladi.
Tasdiqlash vazifalari:
Si → SiO 2 → Na 2 SiO 3 → H 2 SiO 3 → SiO 2
Uy vazifasi
Adabiyot 3.
§30-33 da ishlaydi
Silikon. Silan, silikat, silikon oksidi (IV). Silisli kislotalar, silikatlar
8.1. Silikon. Silan, silisidlar
Silikon uglerodga o'xshash, ammo uning metall bo'lmagan xususiyatlari uglerodga qaraganda kamroq aniqlanadi.
Kremniy uchun sp 3-gibrid holat yanada xarakterlidir, shuning uchun silikon tarkibida 4 va -4 oksidlanish holatini namoyish qilishi mumkin.
Silikon - Yerdagi kisloroddan keyin eng keng tarqalgan element. Yer qobig'idagi silikonning massa ulushi 27,6% ni tashkil qiladi. Tabiatda silikon qum, kvarts shaklida topilgan silika kabi oksidli SiO2 shaklida taqsimlanadi. Tabiiy silikon birikmalarining yana bir guruhi - silikat kislotalarning tuproqlari. Dala shpati (albit) NaAlSi 3 O 8, feldispat (ortoklaz) KAlSi 3 O 8 gil (kaolin) Al 2 O 3 2SiO 2 2H 2 O, nefelin Na 3 K 4 va boshqalarni o'z ichiga olgan eng keng tarqalgan aluminosilikatlar. Yer qobig'ining qobig'ini hosil qiladi. O'simliklar va hayvonlarda silikon birikmalari mavjud.
Ishga kirishish
Sanoatda silikon SiO 2 ni elektr pechlarda koks yordamida kamaytiradi:
SiO 2 2C = S 2CO
Laboratoriyada magniy yoki alyuminiy yordamida reducing agent sifatida:
SiO 2 2Mg = Si 2MgO 3SiO 2 4Al = 3Si 2Al 2 O 2
Eng sof kremniy silikon tetrakloridning 1200 ° S da vodorod bilan kamayishi bilan erishiladi: SiCl 4 2H 2 = Si 4HCl
^ Jismoniy xususiyatlar
Kristalli silikon temir parıltısı bo'lgan quyuq kulrang modda. Kremniyning tuzilishi olmos tarkibiga o'xshash. Uning kristalli qismida har bir atom to'rtta tetraedral tomonidan o'ralgan va ular bilan olmosdagi uglerod atomlari orasidagi juda zaif bo'lgan kovalent birikma bilan bog'langan.
Oddiy sharoitlarda ham, kremniy kristallida kovalent bog'larning ayrimlari yo'q qilinadi. Shuning uchun, u past elektr o'tkazuvchanlikka olib keladigan erkin elektronlarni o'z ichiga oladi. Yoritish va isitish vaqtida singan bog'lanish sonini oshiradi, ya'ni erkin elektronlar soni ortadi va elektr o'tkazuvchanligi oshadi. Shunday qilib, silikon yarim Supero'tkazuvchilar xususiyatlarini tushuntirishi kerak. Silikon juda nozik, uning zichligi 2,33 g / sm3 ni tashkil qiladi. Ko'mir kabi, silikon refrakter moddadir.
Silikon uchta barqaror izotoplardan iborat: 28 14 ta (92,27%),
29 14 ni (4,68%) va 30-14 sini (3,05%) tashkil etadi.
^ Kimyoviy xossalari
By kimyoviy xossalari Silikon, uglerod kabi, metall bo'lmagan, ammo uning metall bo'lmaganligi kamroq ko'rinadi u kattaroq atom radiusiga ega. Kremniy atomlarining tashqi energiya darajasida 4 ta elektron mavjudligi sababli, ham -4 va 4 ning oksidlanish holati silikon uchun odatiy hisoblanadi.
Oddiy sharoitlarda silikon juda inertdir, bu uning kristalli tizimining kuchi bilan izohlanadi. To'g'ridan-to'g'ri u ftor bilan o'zaro ta'sir qiladi:
Si 2F 2 = SiF 4
Kislorod oksidi (IV) ga kislorod bilan qizdirilganda siqilgan silikon:
SiO 2 = SiO 2
Silikon 400-600 ° S da xlor bilan reaksiyaga kiradi:
Si2Cl2 = SiCl4
Qachon juda ko'p yuqori haroratlarda silikon to'g'ridan-to'g'ri uglerod va azot bilan birlashtirilishi mumkin:
3Si 2N 2 = Si 3 N 4
Silikon karbid SiC (karborund) olmosga o'xshash kristall panjaraga ega bo'lib, unda har bir silikon atomining to'rtta uglerod atomiga ega bo'lishi va buning aksi bo'lib, kovalent aloqalar olmos kabi juda kuchli. Shuning uchun u qattiqlikda yaqin
Olmosga. Taşlama toshlari va silliqlash g'ildiragi silikon karbiddan tayyorlangan.
Kislotalar (gidroflorik HF va nitrat HNO 3 aralashmasidan tashqari) silikonga ta'sir qilmaydi. Biroq, u gidroksidi va silikat hosil qiladi:
Si 2NaOH H 2 O = Na 2 SiO 3 2H 2
Sn, Al, Zn, Pb, Au, Ag - ba'zi metallar bilan silikon - kimyoviy ta'sirga ega emas. Boshqa metallar bilan, masalan, Mg, Ca, Cu, Fe, Pt, Bi bilan silikatlar shakllanishi bilan reaksiyaga kirishadi:
2Sa Si = Ca 2 Si
Tarkibiga va xususiyatlariga qarab silikitsalarni ikki guruhga bo'lish mumkin. Birinchisi gidroksidi va gidroksidi tuproq metallar (Li 4 Si, Ca 2 Si) silikidlarini o'z ichiga oladi. Ular silan va sulandırılmış kislotalar bilan silanların ajralib chiqishi bilan ayrışırlar:
Ca 2 Si 4HCl = 2CaCl 2 SiH 4
Metallga o'xshash silitsidlarning eng qizg'in guruhi - o'tish metalllari. Ushbu silitsidlar tarkibida metall kristalli panjarada silikon atomlarining zanjirlari va qatlamlari joylashgan. Ular juda yuqori erish nuqtalari bo'lgan qattiq moddalardir. Silisidlarning yuqori haroratlarda ham oksidlanishiga yo'l qo'ymaslik juda muhimdir. Shunday qilib, MoSi 2 molibden silikitsidi havoda 1600 ° S gacha o'zgarib turmaydi, bu esa elektr pechlari uchun isitgich sifatida foydalanish imkonini beradi.
Metalllarning silikat qatlamlarini shakllanishi turli kimyoviy reagentlarda oksidlanish va korroziyadan himoya qilish uchun keng qo'llaniladi. Ko'pchilik silikatlar yarim o'tkazgichdir.
SiH 4 silan, silikat ustida xlorid kislotadan chiqarib yuborilgan, zaharli gazdir yoqimsiz hid. Silikon gidridlari guruhiga - silikonli vodorod birikmalari kiradi. Silikon vodorod molekulalari uglevodorodlar tarkibida o'xshash. Xona haroratida monosilan SiH 4 va disilan Si 2H 6 gazli moddalar, qolgan silan esa oxirgi ma'lum bo'lgan Si 8H 18ga uchuvchan suyuqliklardir. Ular zaharli va bor yoqimsiz hid. Uglevodorodlarga qaraganda kimyoviy jihatdan kamroq bardoshli.
Silanlarda havo o'zini-o'zi yoqib yuboradi:
SiH 4 2O 2 = SiO 2 2H 2 O
Suv silanlarni parchalab tashlaydi:
Si 2H 6H 4H 2O = 2SiO 2H 7
SiH 4 ning shakllanishi va undan ajralib chiqishi yarim o'tkazgich sanoatida sof kremniyni olish uchun ishlatiladi.
Dastur
Silikon yarim Supero'tkazuvchi sifatida ishlatiladi. Quyoshdan batareyalar ishlab chiqariladi, bu energiyani yorug'lik energiyasini elektr energiyasiga aylantiradi (kosmik qurilmaning radio qurilmalarini elektr ta'minoti). Silikon metallurgiyada yuqori issiqlik qarshiligi va kislotaga chidamliligi bilan silikon po'latlarni ishlab chiqarish uchun ishlatiladi.
^ 8.2. Silikon oksidi (IV)
Silikon oksid (IV) (silika) er qobig'idagi eng keng tarqalgan birikma bo'lib, uning tarkibidagi 12% turli minerallar shaklida. Kristalli va amorf silika bilan ajralib turadi.
1) ^ Kristalli silika - kvarts minerallari va uning navlari (tosh kristall, kalsedon, agat, jasper, chakka) shaklida; kvarts qurilish va silikat sanoati sohasida keng qo'llaniladigan kvarts qumlari asosini tashkil etadi.
2) ^ Amorf silika - SiO 2 nH 2 O opal mineral tarkibi shaklida; amorf kremniyning er shakli diatomit, tripoli (infuzorli er); Sun'iy amorf suspenziya silika misoli natriy metasilikatidan olingan silika gelsidir:
Silika gel ishlab chiqilgan sirtga ega, shuning uchun namlik yaxshi yetsin.
Kvarts- juda qattiq, bardoshli, refraktsion moddalar, erish nuqtasi 1723 ° S. Erigan eritmani tez sovutganda kvarts shishasi hosil bo'ladi. Undan ilmiy laboratoriya uskunalari va asbob-uskunalari ishlab chiqariladi.
Silikon oksid (IV) ning eng oddiy formulasi SiO 2 bo'ladi. Atom kafesida kristallanadi. SiO 2 ning planar tasvirdagi tuzilishi quyidagicha ifodalanadi:

Har bir silikon atomi 4 ta kislorod atomining tetraedrida saqlanadi. Bunday holda silikon atomlari markazda joylashgan va kislorod atomlari tetraedrning ustki qismida joylashgan. Barcha kremniy parchasini kristall deb hisoblash mumkin, uning formulasi (Si0 2) n. Ushbu turdagi kremniy oksidi (IV) tuzilishi yuqori qattiqlik va refrakterlikka olib keladi.
Kimyoviy xossalari
Suvda SiO 2 deyarli erimaydi. Kislota oksidi sifatida, qattiq gidroksidi, asosiy oksidi va karbonatlar bilan birlashganda reaksiyaga kirishib, silika kislotasining tuzlarini hosil qiladi:
SiO 2 2 NaOH = Na 2 SiO 3 H 2 O
SiO 2 CaO = CaSiO 3
SiO 2 Na 2 CO 3 = Na 2 SiO 3 CO 2
Kislotalar SiO 2 ga ta'sir qilmaydi. Faqat hidroflorik kislota asta-sekin uni eritadi:
SiO 2 4HF = SiF 4 2H 2 O
Bu reaktsiya shishani shishirlashning asosi hisoblanadi. SiO 2 ni 2 ° S gacha bo'lgan karbonli aralashmani karbonatli karbid SiC hosil bo'lishiga olib keladi: Karbonund: SiO2 2C = SiC2CO
Dastur
Silikon oksidi (IV) silikat sanoatida shisha, keramika, beton buyumlar, silikat g'ishtlarini ishlab chiqarishda keng qo'llaniladi. To'g'ri kvarts qurilma ishlab chiqarishda ajralmas hisoblanadi. Kvarts kristalllari piezoelektr bo'lib, ular deyarli elektr energiyasini mexanik energiyaga aylantirmasdan turib o'zgartirishi mumkin. Kvartsning kichik kristallari va piezoelektrik plitalar ishlab chiqarish chiqindilaridan kvarts olish
Jadval 26.
Silik kislotasi
Shisha U nafaqat ko'zga ko'rinadigan yorug'lik, balki shifobaxsh ta'sirga ega ultrabinafsha uchun ham shaffofdir.
^ 8.3. Silisli kislotalar, silikatlar
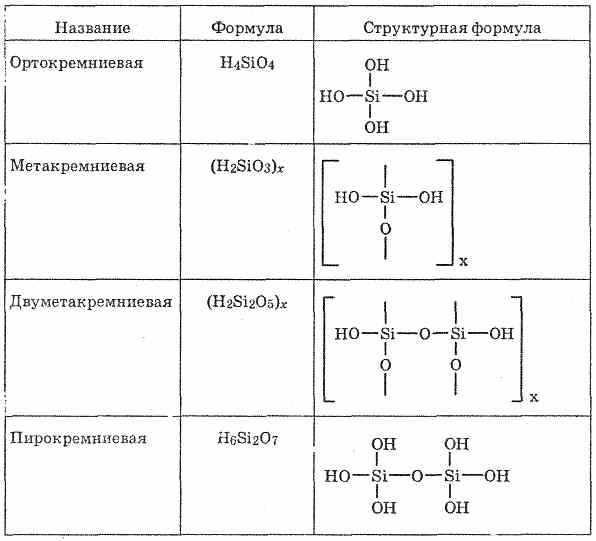
Silikat kislota - silikon oksid (IV) ning suvi, juda zaif kislotalar. Kremniy kislotalarda SiO 2 va H 2 O nisbati juda farq qiladi, shuning uchun ularning tarkibi odatda "SiO 2 mH 2 O" umumiy formulasi sifatida ifodalanadi. n osonlik bilan bir-biriga aylanadi. Erkin holatda Orthossicic kislotasi H 4 SiO 4, metaksilaminik H 2 SiO 3 va bir nechta boshqa kislotalar izolyatsiya qilingan (26-jadvalga qarang).
Silisik kislota bilvosita harakatga kiradi. kaliy yoki natriy silikat kislotasi:
Na 2 SiO 3 2HCl = 2NaCl H2S03 3
Silik kislotasi sof shaklda olinmaydi. Suvli eritmalarda kolloid eritma hosil qiladi, yoki chap, juda qisqa vaqt ichida mavjud. Chapga qo'shimcha poraguslanadi va bir jel hosil bo'ladi. Jel quritilganda, gözenekli bir tuzilishga ega mahsulotlar tashkil qilinadi - silika jelleri qurituvchi va adsorban sifatida ishlatiladi.
H 2 SiO 3 - kislota juda zaif, suvda bir oz eriydi. Issiqlik vaqtida osonlik bilan karbonat kislotasi singari ajralib chiqadi:
H 2 SiO 3 = H 2 O SiO 2
Dibazik kislota bo'lib, u quyidagi bosqichlarda ajralib chiqadi:
H 2 SiO 3 H HSiO - 3
HSiO-3HH SiO 2-3
Sililik kislota ko'mirdan kuchliroqdir.
Suvli eritmalarda karbonat kislotasi ularning tuzlaridan silisga aylanadi:
Na 2 SiO 3 H 2 O CO 2 = Na 2 CO 3 H 2 SiO 3
Silikat kislota tuzlari silikatlar deyiladi. Ularning tarkibi odatda elementlarning oksidlari birikmalariga o'xshash formuladan iborat. Masalan, CaSiO 3 kaltsiyli silikat quyidagicha ifodalanadi: CaO SiO 2.
Silikatlar ko'pincha suvda erimaydi. Istisnolar, masalan, SiO 2 ni mos keladigan gidroksidlar yoki karbonatlar bilan birlashtirib, natriy va kaliy silikatlaridir, masalan:
SiO 2 Na 2 CO 3 = CO 2 Na 2 SiO 3
Ushbu tuzlarning suvli eritmalariga «suyuqlik oynasi» deyiladi. Hidroliz natijasida "suyuq shisha" kuchli gidroksidi reaktsiyaga ega. " Suyuq shisha"Kislota chidamli beton ishlab chiqarishda hamda yopishtiruvchi va yopishtiruvchi plitalar ishlab chiqarishda bog'lovchi sifatida ishlatiladi. Ular yong'inga chidamlilik va suv o'tkazmasligi uchun mato, yog'och va qog'oz bilan emlanadi.
Yer qobig'i silikon oksid (IV) va turli silikatlardan iborat. Tabiiy silikatlar kompleks tarkibiy va tuzilishga ega. Masalan:
Feldspar K 2 O Al 2 O 3 6SiO 2 mika K 2 O 3Al 2 O 3 6SiO 2 2H 2 O asbest 3MgO 2SiO 2 2H 2 O kaolin Al 2 O 3 2SiO 2 2H 2 O
Aluminiyli silikatlarga aluminosilikatlar deyiladi. Tabiatda ular feldspat kabi keng tarqalgan, shuningdek turli xil aralashmalar
Nix silikatlari. Shunday qilib, toshlar - granit va gnayslar - kvarts kristallari, dala shpati va mika.
Yerning yuzasida tog 'va minerallar harorat va undan keyin karbon dioksid ta'siri ostida yo'qoladi, ya'ni. sekin tushadi.
K 2 O Al 2 O 3 SiO 2 2H 2 O CO 2 Al 2 O 3 2SiO 2 2H 2 O K 2 CO 3 4SiO 2
Tahribotlarni eng asosiy mahsuloti kaolinit mineralidir - oq loyning asosiy komponenti. Tog' jinslarining ajralishi natijasida loy, qum va tuzlarning konlari hosil bo'lgan.
Silikatlarning tarkibi tarkibi va tuzilishiga qarab juda farq qiladi. Ko'pincha silikatlar shaffof va juda chiroyli rangli kristallar shaklida bo'ladi; ulardan ba'zilari zargarlik buyumlarida ishlatiladigan qimmatbaho toshlar (garnet, topaz, zumrad va boshqalar). Silikatlarning zichligi odatda 2 dan 4 g / sm3 gacha. Qattiqlik ba'zan juda kichik (masalan, talk), ammo juda muhim (masalan, zirkon ZrSiO 4). Silikatlar qizdirilganda ular eriydi yoki qattiq holatda ajraladilar. Erish nuqtalari 750 dan 2000 ° C gacha, ba'zan ular esa yuqori bo'ladi.
Sun'iy silikatlar, shisha, tsement va keramikalarning ahamiyati katta.
Oddiy oyna oynasining tarkibi taxminan Na2O CaO 6SiO 2 formulasi bilan ifodalanadi. Shisha, maxsus nonvoyxonalarda Na 2 CO 3 soda, ohak CaCO 3 va oq qum SiO2 aralashmasidir aralashmasidan hosil bo'ladi.
SiO 2 Na 2 CO 3 = Na 2 SiO 3 CO 2
SiO 2 CaCO 3 = CaSiO 3 CO 2
Na 2 SiO 3 CaSiO 3 4SiO 2 = Na2O CaO 6SiO 2
Maxsus oynalar uchun dastlabki aralashmaning tarkibini o'zgartiring. Soda Na 2 CO 3 potash K 2 CO 3 bilan almashinadi, olovli shisha (kimyoviy idishlar uchun) olinadi. CaCO 3-oksidini oksid (II) PbO va kaliy soda bilan almashtirish, kristall stakanni olish. Birinchi oksidga metall oksid qo'shilishi stakanga boshqa rang beradi: krom (III) oksidi Cr 2 O 3 - yashil, kobalt (II) oksid KoO - ko'k, marganets (IV) oksid MnO 2 - qizil-binafsharang va boshqalar.
Borayotgan harorat bilan, ko'zoynak asta-sekin yumshatadi va suyuqlikka aylanadi. Orqa jarayonlar asta-sekin amalga oshiriladi - shisha massasi u soviganida qalinlashadi. Undan chikarish bu oynali xususiyatga asoslangan.
Turli mahsulotlar. Shisha koptoklardan olinadigan mashinalar yordamida choyshab oynasi.
Tsement
Oddiy silikat tsement yoki portland tsementi - suv bilan aralashtirilganda, toshga o'xshash massaga havoda (yoki suvda) qotib turadigan yashil-kulrang kukun. Odatda ohak va gildan iborat xom ashyo aralashmasini sinterlemadan oldin qovurish (1400-1600 ° C) bilan olinadi.
Qattiqlashgandan so'ng tsement, suv va agregatlar (qum, shag'al, maydalangan tosh, shlak) aralashmasi sun'iy tosh beton ishlab chiqaradi. Temir beton bilan temir beton deb ataladi. Organik polimerlar yoki polimerlar tsement bilan biriktiruvchi sifatida ishlatiladigan betonlar plastik beton deb ataladi.
Kulolchilik
Seramika materiallari va tabiiy killerdan ishlab chiqarilgan turli xil mahsulotlar va ularning mineral aralashmalari bilan aralashmalari, shuningdek, oksidlar va boshqa noorganik birikmalar, kalıplama, qovurish va quritish orqali. Ular g'isht, karo, plitka, trubalar, kulolchilik, chinni va fayans mahsulotlari.
Shisha, tsement va keramika ishlab chiqarish silikat sanoatiga kiradi, tabiiy kremniy birikmalarini qayta ishlaydi.
Insoniyat antik davrda kremniy bilan tanishdi. Bu ibtidoiy odamlar o'z vositalarini yaratgan. Keyinchalik u kremniy asosida odamlar shisha ishlab chiqargan edi. Kremniy birikmalar juda uzoq vaqtdan beri ma'lum bo'lishiga qaramay, toza silikon nisbatan yaqinda olingan. 1823 yilda buyuk olim Berzeliyos sof amorf silikon olish imkoniyatiga ega edi va 1854 yilda A. Sit-Clair Devil kristalli kremniyni oldi. Tarjima elementining nomi "qattiq tosh" degan ma'noni anglatadi. jismoniy xususiyatlar.
Tabiatda silikon o'zining sof shaklida topilmaydi, ko'pincha u SiO2 oksidi, minerallar yoki silika kislotasi tuzlari bilan ifodalanadi.
Silikon asosidagi minerallar alohida ahamiyatga ega. Silisyum chinni, asbest, otoklaz, feldspat, kvarts va kristall kabi minerallarning asosidir. Ushbu minerallar butun tog'larni hosil qiladi va ko'plab qumlar juda ko'p miqdorda iflosliklarga ega bo'lgan kvartsdan boshqa hech narsa emas. Silikon hayvonlarda va o'simliklarda keng tarqalgan emas. Jonivor to'qimalarida uning miqdori juda kichik va yoshi kamayib boradi.
Silikon oksidini yuqori haroratda kamaytirish orqali olinadi:
SiO 2 + C = Si + 2CO
3SiO 2 + 4Al = 3Si + 2Al2O3
Bundan tashqari, silikon silanning (vodorod silikon birikmalari) termal dekompozitsiyasi bilan erishiladi,
Silikon odatda metall bo'lmagan, uning guruhining barcha xususiyatlariga ega.
1) kislorod bilan ta'sir o'tkazish
Olingan kremniy oksidi 4 xususiyatiga ta'sirsiz, reaksiyaga kirishish qiyin, ammo u hidroflorik kislota bilan faol reaksiyaga kirishadi:
4HF + SiO 2 = SiF 4 + 2H 2 O
2) Halogen bilan o'zaro ta'sir
Xona haroratida silikon faqat flor bilan reaksiyaga kiradi, qizdirilganda esa xlor bilan reaksiyaga kiradi.
Si + 2Cl 2 = SiCl 4
3) Uglerod bilan o'zaro ta'siri
Si + C = Si +4 C -4
Ushbu reaksiya natijasida modda karborunddan olinadi. Noyob jismoniy xususiyatlarga ega: uning kuchi olmosga o'xshash.
Karborundda uglerod oksidlanish holatini aks ettiradi va davriy jadvalda bu elementlarning pozitsiyasi tufayli silikon ijobiy hisoblanadi.

4) Metalllar bilan o'zaro ta'siri
Si + 2Mg = Mg 2 Si
Si + 4Na = Na 4 Si
Olingan moddalarga silikatlar deyiladi. Kuchli kislotalar ularga ta'sir qilganda, sila gazi ajralib chiqadi, bu uning kimyoviy xossalari bilan alkanlarga juda o'xshaydi, lekin uzoq bog'lanish uzunligi tufayli ancha kamroqdir.
5) Oksidlarni qayta tiklash
Bilan yuqori harorat silikon oksidlaridan ko'plab metallarni qayta tiklashga qodir.
2CuO + Si = SiO2 + 2Cu
6) gidroksidi bilan o'zaro ta'siri
Yuqori haroratlarda silikon alkali eritmalar bilan reaksiyaga kirishadi.
Si + 2NaOH + H 2 O = Na 2 SiO 3 + 2H 2 (natriy metaxilat)
Si + 4NaOH = Na 4 SiO 3 + 2H 2 (natriy orthoxylate)
Xususiyatlar
14 Si.|
Atom massasi |
klark, at.% (tabiatdagi tarqalish) |
||
|
Elektron konfiguratsiya * |
Birlashma holati |
qattiq |
|
|
quyuq kulrang porloq |
|||
|
Ionlashtiruvchi energiya
|
|||
|
Nisbiy elektro-salbiylik |
Zichlik |
||
|
Oksidlanishning mumkin bo'lgan holatlari |
Standart elektrod salohiyati |
Elementning atomining tashqi elektron darajalarining konstruktsiyasi. Qolgan elektron sathlarning konfiguratsiyasi oldingi davrni yakunlovchi va qafaslarda ko'rsatiladigan nobel gaz uchun mos keladi.
Tabiatda bo'lish.
Kisloroddan keyin silikon qobiqdagi eng keng tarqalgan element hisoblanadi. Erkin holatda uglerod farqli o'laroq, silikon tabiatda topilmaydi. Uning eng keng tarqalgan birikmalari silikon oksid (IV) SiO 2 va silisli kislota tuzlari - silikatlar. Er qobig'ining qobig'ini hosil qiladi. O'simliklar va hayvonlarda silikon birikmalari mavjud.Tabiiy silikatlar kompleks tarkibiy va tuzilishga ega. Ba'zi tabiiy silikatlar tarkibiga quyidagilar kiradi: feldspar K
2 o × Al 2 O 3 × 6SiO 2, asbest 3 Mg O × 2SiO 2 × 2H 2 O, vodamlar K 2 O × 3 A l 2 O 3 × 6SiO 2 × 2H 2 O,kaolinit 3 A l 2 O 3 × 2SiO 2 × 2H 2 O.Aluminiyli silikatlar ham deyiladi aluminosilikatlar. Yuqoridagi silikatlardan aluminosilikatlar feldspar, kaolinit va mika. Tabiatda alyuminosilikatlar, masalan, feldispatlar eng keng tarqalgan. Turli silikatlarning aralashmalari ham keng tarqalgan. Shunday qilib, toshlar - granit va gnayslar - kvarts kristallari, dala shpati va mika.
.Tahribotlarni eng asosiy mahsuloti kaolinit mineralidir - oq loyning asosiy komponenti. Tog' jinslarining ajralishi natijasida loy, qum va tuzlarning konlari hosil bo'lgan.
Qabul qilish. Silikon sanoati tiklanish yo'li bilan ishlab chiqariladi
SiO 2 elektr pechlarda koks:Laboratoriyada magniy yoki alyuminiy yordamida reducing agent sifatida:
Eng sof kremniy silikon tetrakloridning sink bug'lari bilan pasayishi bilan erishiladi:
Dastur.
Silikon yarim Supero'tkazuvchi sifatida ishlatiladi. Quyosh energiyasidan foydalanadigan energiya manbalaridan energiya ishlab chiqaradigan quyosh kameralari ishlab chiqariladi. Silikon metallurgiyada yuqori issiqlik qarshiligi va kislotaga chidamliligi bilan silikon po'latlarni ishlab chiqarish uchun ishlatiladi.Jismoniy xususiyatlar. Kristalli silikon temir parıltısı bo'lgan quyuq kulrang modda. Kremniyning tuzilishi olmos tarkibiga o'xshash. Uning kristalli qismida har bir atom to'rtta tetraedral tomonidan o'ralgan va ular bilan olmosdagi uglerod atomlari orasidagi juda zaif bo'lgan kovalent birikma bilan bog'langan. Oddiy sharoitlarda ham, kremniy kristallida kovalent bog'larning ayrimlari yo'q qilinadi. Shuning uchun, u erkin elektrlarga ega, ular kichik elektr o'tkazuvchanligiga olib keladi. Yoritish va isitish vaqtida singan bog'lanish sonini oshiradi, ya'ni erkin elektronlar soni ortadi va elektr o'tkazuvchanligi oshadi. Shunday qilib, silikon yarim Supero'tkazuvchilar xususiyatlarini tushuntirishi kerak.
Silikon juda nozik, uning zichligi 2,33 g / sm3 ni tashkil qiladi . Ko'mir kabi, refrakter moddalarni nazarda tutadi.
Silikon uchta barqaror izotopdan iborat: 28, 14-Si (92.27%), 29-14-Si (4.68%) va 30-14 Si (3,05%).
Kimyoviy xossalari
Kimyoviy xususiyatlarga ko'ra, silikon kabi uglerod metall bo'lmagan, ammo uning metall bo'lmaganligi kamroq aniq, chunki u kattaroq atom radiusiga ega. Kremniy atomlari tashqi energiya darajasida 4 elektronga ega bo'lgani uchun ham -4 va +4 ning oksidlanish holati silikonga (oksidlanish darajasi +2 bo'lgan joyda ma'lum bo'lgan silikon birikma) ma'lum.Oddiy sharoitlarda silikon juda harakatsizdir, bu uning kristalli kafesinin kuchi bilan tushuntirilishi kerak. To'g'ridan-to'g'ri u ftor bilan o'zaro ta'sir qiladi:
![]()
Kislotalar (gidroflorik aralashdan tashqari)
HF va azotli HNO 3 a) silikon ustida harakat qilmang. Ammo, u gidroksidi gidroksidlarda eriydi va silikat va vodorod hosil qiladi:Kremniy, kristal va amorf ikki xil allotropik modifikatsiyadan amorf silikon kimyoviy jihatdan faolroqdir. Issiq isitilganda kislorod bilan reaksiyaga kiradi
SiO 2:![]()
va barcha halogenlar bilan, masalan:
![]()
Yuqori haroratlarda silikon uglerod bilan hosil qiladi karborund
SiC:![]()
Karborundda olmosga o'xshash kristalli latta bor, unda har bir silikon atomi to'rtta uglerod atomlari bilan va u bilan kesishadi va kovalent aloqalar juda olmos kabi. Shuning uchun qattiqlikda olmos yaqin. Taşlama toshlari va silliqlash g'ildiraklari silikon karbiddan tayyorlanadi.
Magniy silikat. Faol metallar bilan reaksiyalarda, shakllanish jarayonida yuzaga keladi silisidlar, Silikon oksidlovchi moddalar vazifasini bajaradi:
![]()
Yuqori haroratlarda silikon oksidlaridan ko'plab metallarni qayta tiklaydi.
Silan Silikatlar bo'yicha gidroksidi kislotaning ta'siri ostida eng oddiy vodorod silikon birikmasi olinadi silan
SiH 4: - yoqimsiz hidli zaharli gaz, havoda o'z-o'zidan titraydigan:Silikon oksidi
(IV)Silikon oksid (IV) ga silika deyiladi. Bu qattiq refrakter moddadir.(1700 ° C erishi nuqtasi), tabiatda keng tarqalganturlari: 1) kristalli silika - kvarts minerallari va uning navlari (tosh kristall, kalsedon, agat, jasper, chakka) shaklida; kvarts qurilishda va silikat sanoatida keng qo'llaniladigan kvarts qumlarning asosini tashkil etadi; 2) amorf silika - SiO 2 opal mineral tarkibi shaklida × n H 2 U; amorf kremniyning er shakli diatomit, tripoli (infuzorli er); Sun'iy amorf suspenziya silika misoli natriy metasilikatidan olingan silika gelsidir:
Silika jeli rivojlangan sirtga ega va shuning uchun namlikni yaxshi qabul qiladi.
1710 ° kvarts eriydi. Eritilgan massaning tez sovishi bilan
kvarts shishasi hosil bo'ladi. Issiq kvarts shishasi suvni tez sovutganda yorilishiga yo'l qo'ymasligi uchun juda kam koeffitsientga ega. Laboratoriya uskunalari va asbob-uskunalari ilmiy tadqiqotlar uchun kvarts shishasidan ishlab chiqariladi.Silikon oksid (IV) ning eng oddiy formulasi SO 2 karbon monoksit (IV) S formula bilan o'xshashO 2 . Ayni paytda, ularning jismoniy xususiyatlari juda farq qiladi (SiO2 - qattiq CO 2 - gaz). Bu farq kristalli lattalarning tuzilishiga bog'liq. C0 2 molekulyar qafada kristallanadi, SiO 2 - Atomda. TuzilishiSiO 2 tekis rasmda quyidagicha ifodalanishi mumkin: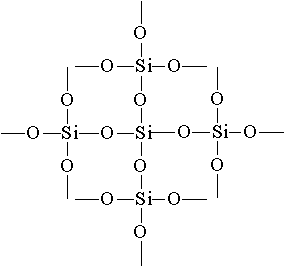
Qattiq S ning uglerod atomining muvofiqlashtiruvchi soni
O 2 2 va silikonning tengligi SiO 2 har bir silikon atomi 4 kislorod atomining tetraedrida joylashgan. Bunday holda silikon atomlari markazda joylashgan va kislorod atomlari tetraedrning ustki qismida joylashgan. Barcha kremniy parchasini kristall deb hisoblash mumkin (SiO 2). Bunday struktura kremniy oksidi (IV) uning yuqori qattiqligini va refrakterligini aniqlaydi.Silikon oksidning (IV) kimyoviy xossalari
SiO 2 kislota oksidi degan ma'noni anglatadi. Qattiq gidroksidi, asosiy oksidi va karbonat bilan eritib, silisli kislota tuzlari hosil bo'ladi: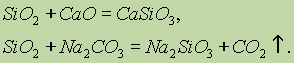
Faqat hidroflorik kislota silikon oksidi (IV) bilan o'zaro ta'sir qiladi:
Bu reaksiya bilan shisha idishga solingan.
Silikon (IV) oksidi suvda erimaydi va u bilan kimyoviy ta'sir o'tkazmaydi. Shuning uchun kremniy kislotasi kaliy yoki natriy silikat eritmasi bilan kislota bilan harakat qilib bilvosita olinadi:
Bunday holda silisli kislota
(tuz va kislota dastlabki eritmalarining konsentratsiyasiga qarab) suvni o'z ichiga olgan jelatinli massa shaklida va kolloid eritma shaklida (chap) shaklida olinishi mumkin.Silik kislotasi.
SiO 2 tarkibi umumiy formulada ifodalanishi mumkin bo'lgan bir qator silisli kislotalarning anhidrididir xSiO 2 × yH2O, Bu erda x va y - tamsayılar: = 1, y = 1: SiO 2 × H 2 O, ya'ni H 2 SiO3 - metasilik kislota;2) x = 1, y = 2: SiO 2 × 2H 2 O, ya'ni H 4 SiO 4 - ortosilik kislotasi;
x = 2, y = 1: 2SiO 2 × H 2 O, ya'ni H 2 Si 2 O 5 - bimetakritik kislota. Kremniy kislotasi tetrahedral strukturalardan tashkil topgan (har bir bunday birlikda silikon atomi tetraedrning markazida, tepada esa kislorod atomlari mavjud). Zanjirlar bilan birikib, strukturaviy aloqalar yanada barqaror polisilikon kislotalarni hosil qiladi:
Bunday birikmalarning tarkibi quyidagi formulada ifodalanishi mumkin
(H 2 SiO 3) n. Ammo, odatda, kremniy kislotasi formulalar bilan ifodalanadi H 2 SiO 3. H 2 SiO 3 - kislota juda zaif, suvda bir oz eriydi. Issiqlik vaqtida osonlik bilan karbonat kislotasi singari ajralib chiqadi:Barcha silik kislotalar juda zaif (ko'mirdan zaif).
Silikatlar.
Barcha silisli kislotalarning tuzlari deyiladi silikatlar, odatda, o'quv adabiyotlarida silikatlar meta-silisli kislota tuzlarini bildiradi. Ularning tarkibi odatda elementlarning oksidlari birikmalariga o'xshash formuladan iborat. Masalan, kaltsiy silikat CaSiO 3 quyidagicha ifodalanishi mumkin: Cao ×SiO 2.Silikatlar tarkibi
R 2 O × nSiO 2, bu erda R 2 O - natriy yoki kaliy oksidi deyiladi eruvchan shisha va ularning konsentrlangan suvli eritmalari - suyuq shisha. Eng muhimi, natriy eruvchan shisha.Atmosferada karbonat angidrid (IV) silikat kislota tuzlaridan ajralib chiqqandan so'ng, havoda turganda silikatlarning eritmalari xiralashadi.
Silik kislotasi suvda deyarli erimaydi - bu xususiyat ionga sifatli reaktsiya sifatida ishlatiladi
SiO 3 2 - .Silikatlar gidroksidi yoki karbonatlar bilan silika bilan eritiladi:
Silikatlardan foydalanish.
Eng ko'p ishlatiladigan silikatlar natriy va kaliydir. Bu tuzlarning konsentrlangan eritmalari chaqiriladi suyuq shisha; ular gidroliz tufayli kuchli gidroksidi reaktsiyaga ega. Suyuq shisha elim va suv o'tkazmaydigan matolarni ishlab chiqarishda qo'llaniladi. Suyuq shisha kislotaga chidamli beton ishlab chiqarishda, shuningdek, macunlar, ofis yelimi ishlab chiqarishda bog'lovchi sifatida ishlatiladi. Ular yong'inga chidamlilik va suv o'tkazmasligi uchun mato, yog'och va qog'oz bilan emlanadi.Mualliflik huquqi © 2005-2013 Xenoid v2.0
Foydalanuvchi bilan aloqa ko'rsatilgan holda materiallardan foydalanish mumkin
| Tegishli maqolalar: | |
|
Qon bosimi keskin o'sishining sababi nima?
Yuqori qon bosimining eng aniq belgilari bosh og'rig'i, ... Og'irlik haligacha - vazni yo'qotish uchun nima qilish kerakligi, qanday qilib uni yutish kerakligi
Uzoq muddatli vazn yo'qotish jarayonida deyarli har bir kishi ... Bitcoin mashinada ishlash usullari
VkontakteOdnoklassniki Bugungi kunda bitcoins (pul elektron to'lovlar ... | |