вибір читачів
Популярні статті
Привіт всім! Багато хто знає, що щавлева кислота викликає утворення каменів в нирках. Але, що це за речовина і де міститься, і як застосовується знають не багато. Тому, з пізнавальної точки зору, ця стаття на про це.
Німецький хімік Фрідріх Велер в 1824 році вперше синтезував щавлеву кислоту. Щавлева кислота (наукова назва - етандіовая кислота), відноситься до групи органічних кислот. У природі щавлеву кислоту можна зустріти у вільному стані і у вигляді оксалатів кальцію і калію.
Трохи про хімічних і фізичних властивостях щавлевої кислоти.
Щавлева кислота - кристалічна, гігроскопічна, безбарвна речовина, без запаху. Вона частково розчинна в спирті (етанолі), воді. Утворює дигідрат щавлевої кислоти.
Щавелева кислота
Отримання щавлевої кислоти:
Ми знаємо, що фізичний стан людини багато в чому залежить від правильної роботи м'язів і нервів. Робота системи кровообігу, травного тракту, органів виділення заснована на перистальтических рухах, які хвилеподібні за своєю природою і складаються з послідовних розслаблень і скорочень м'язів і нервов.Еффектівность цих процесів залежить від їх фізичного стану.
Щавлева кислота є хорошим стимулятором роботи м'язів і нервів.
Слід пам'ятати, що життєві процеси в нашому організмі будуть активні і живі, якщо тканини і клітини органів молоді і здорові. Якщо будь-які частини наших органів починають старіти, то і ефективність їх роботи починає погіршуватися. Такий стан пов'язують з відсутністю або недоліком живих атомів в їжі, які доставляються тканин і клітин.
Що ж таке - жива їжа? Це їжа, яка містить живі органічні ензими і атоми, що містяться в сирих продуктах.
Розглянемо це питання на прикладі щавлевої кислоти. Щавлева кислота в продуктах (в сирих соках і овочах) є органічною, вона рясніє ензимами, т. Е. Є не тільки корисною, але й життєво необхідною для нормальної роботи нашого організму.
А ось в термічно обробленої їжі вона стає неорганічної і у неї з'являються шкідливі властивості, які часом стають просто руйнівними.
Щавлева кислота легко взаємодіє з кальцієм. Якщо обидві речовини органічні, то щавлева кислота сприяє засвоєнню кальцію, а це стимулює перистальтичні функції організму.
Але якщо в процесі обробки їжі щавлева кислота стає неорганічної, то утворюються сполуки, в яких відбувається руйнування кальцію і утворення солей щавлевої кислоти - оксалатів. Це, в свою чергу, викликає руйнування кісткової тканини, утворення каменів, сприяє виникненню таких захворювань як артрити, артрози, імпотенція і ін.
Тому слід пам'ятати, що надлишок щавлевої кислоти і утворені нею з'єднання можуть завдати шкоди організму.
Звичайно, якщо травна система здорова, то оксалати не завдадуть особливої \u200b\u200bшкоди, а ось якщо ви страждаєте, подагрою, сечокислий діатез, то слід зменшити вживання продуктів, що містять щавлеву кислоту.
Підвищений вміст щавлевої кислоти в продуктах може викликати ряд інших симптомів: розлад шлунка, слабкість, утруднене дихання, нудоту, різі в животі.
Для людей, які не страждають вищепереліченими хворобами, дані продукти (за винятків деяких) не принесуть шкоди, а тільки користь.
Симптоми отруєння щавлевої кислотою.
Після внутрішнього прийому великої кількості щавлевої кислоти виникає біль в ротовій порожнині, по ходу стравоходу і в шлунку. З'являються блювання, ниткоподібний пульс, порушення координації руху. Пізніше - ознаки уремії і ниркової недостатності.
Перша допомога при отруєнні кислотою.
Якщо щавлева кислота приймалася всередину, її необхідно нейтралізувати. Для цього хворому потрібно призначити солі кальцію для внутрішнього застосування (крейда, хлорид кальцію, глюконат кальцію, лактат кальцію і ін.). При погіршенні стану направити хворого в стаціонар.
Вимоги безпеки при транспортуванні і зберіганні щавлевої кислоти.

Всім привіт!
Як вам моя історія про лікарів в попередній статті? Що думаєте з цього приводу?
А взагалі мене життя чомусь часто зіштовхує з ось таким нерозумінням. Пам'ятаю, коли переїхала з Курчатова в Усть-Каменогорськ, то пішла в Центр обслуговування населення (ЦОН) прописуватися, там оператор почала заповнювати на мене анкету і дійшла до освіти. На питання, хто я за дипломом, я відповіла «хімік-аналітик».
У бідної дівчинки-оператора (на вигляд - років 18, не більше) стали квадратні очі і вона мало не пошепки перепитала: «А це значить вчитель хімії, так?». Мені після всіх поневірянь з квартирою і пропискою було вже все одно, тому я кивнула: «Так, пишіть, вчитель хімії».
Погано мати маловідому професію 🙂
І після цього невеликого відступу я повертаюся до цікавих хімічних речовин, про які недавно почала розповідати - кислотам. Я вже розповіла про лимонної і ацетилсаліцилової.
Сьогодні мова піде тому, що таке щавлева кислота: застосування в побуті, властивості, запобіжні заходи при роботі з нею. Або ви думаєте, що вам це не потрібно, тому що ви з нею ніде не стикаєтеся? Даремно. Давайте подивимося.
Це органічна кислота, яка в природі зустрічається в деяких рослинах. Найбільше її в щавлі, шпинаті і ревені. Саме вона надає їм кислий смак. Як не дивно, багато її в шоколаді, буряках і міцному чорному чаї.
Солі щавлевої кислоти називаються оксалатами. Думаю, це слово ви часто чули, особливо ті, у кого проблеми з відкладенням солей у суглобах або з каменями в нирках - це саме нерозчинні оксалати кальцію. Саме тому при лікуванні лікарі рекомендують понизити вживання продуктів, в яких багато щавлевої кислоти.
Природні сполуки щавлевої кислоти - це, частіше за все, оксалати калію.
Цікаво, але щавлева кислота зіграла значну роль в розвитку органічної хімії як науки. Справа в тому, що на початку 19-го століття вчені чітко розділяли всі речовини на так звані мінеральні та органічні. Причому, перші могли існувати тільки в живих організмах, а другі - відповідно, в неживих предметах.
І ось в 1824 році німецький хімік Фрідріх Велер зруйнував ці уявлення тим, що отримав органічна речовина (щавлеву кислоту) з неорганічних речовин. Ну а після цього подібні відкриття пішли одне за іншим. У підсумку, вчені прийшли до того, що прірви між неорганічними і органічними речовинами не існує, для всіх них діють одні і ті ж закони.
Ось таке цікаве речовина - ця щавлева кислота або «щавелька», як називають її хіміки в лабораторіях, часто використовуючи її для приготування сумішей для миття хімічного посуду.
Що й казати, воно величезне:
Ну а в побуті основне її застосування - входить до складу миючих засобів як відбілюючий і дезинфікуючий речовина.
Найпоширеніше застосування - очищення від іржі. Причому, це властивість щавлевої кислоти легко розправлятися з іржею дійсно і для сантехніки, і для металевих деталей, і навіть для плям іржі на одязі.
Колись один мій колега повісив свій білий светр сушитися на батарею і не звернув увагу, що на ній є патьоки іржі. У підсумку на светрі залишилися іржаві плями. Я тоді працювала в лабораторії, ми дали йому трохи щавлевої кислоти, за допомогою якої він і врятував свій одяг.
Зараз чисту щавлеву кислоту знайти і купити проблематично, принаймні, у нас, в Казахстані, але її легко можна знайти в складі самих різних порошків для чищення труб, миючих засобів, а також «антинакипін». До речі, поки писала, мені підказали, що її можна знайти в магазинах для бджолярів і в ветеринарних магазинах.
Ну а як користуватися? Легко. Чайну ложку розчиняємо з літрі теплої води - ось і готовий розчин проти іржі.
Тільки не забувайте про заходи обережності! Ця речовина відноситься до другого класу небезпеки - дратує верхні дихальні шляхи, має яскраво виражену подразнюючу дію для шкіри і слизових оболонок. Причому, це стосується не тільки самої кислоти, але і її солей. Крім того, пил її пожежонебезпечна.
А тепер - то, що викликало моє величезне здивування, а потім - обурення. Коли шукала матеріал до це статті, то перерила багато довідкової та спеціальної літератури як в паперовому, так і електронному вигляді, і також спробувала шукати інформацію в інтернеті. Я кажу «спробувала», тому що практично в кожній другій статті мені попадався такий жах ... Я навіть не знаю, якими словами це описати. Судіть самі, ось скріншот частини статті на одному з таких сайтів:
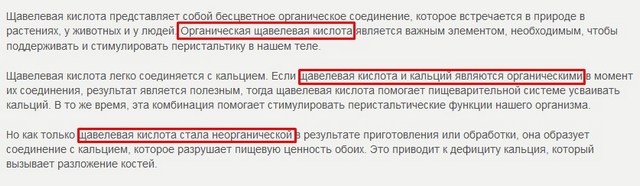
А як вам таке:

Як може органічна щавлева кислота раптом перетворитися в неорганічну ?! Ну що за маячня-то! Речовина - завжди одне, якщо з ним відбуваються якісь хімічні перетворення, то воно перетворюється в іншу речовину, яке буде називатися по-іншому, мати іншу будову та інші властивості.
Але такого, щоб речовина раптом зазнало якісь хімічні перетворення і залишилося самим собою - не буває такого! А органічний кальцій - це синонім білої сажі! Не буває органічного кальцію.
Особливо порадувало «руйнування кальцію», яке відбувається при обробці їжі. А вона, бува, не в атомному реакторі обробляється? Адже тільки ядерні реакції здатні зруйнувати будь-якої хімічний елемент.
Коротше, якщо ви бачите подібний сайт - біжіть від нього з усіх ніг. Їх автори безграмотні і дурні. Безграмотні - тому що не знають елементарного шкільного курсу хімії, а дурні - бо переписують один в одного подібну нісенітницю, навіть не замислюючись над тим, що вони пишуть. І ніякої вікіум їм уже не допоможе.
Це як в статті про воду з «живою активним середовищем», про яку я вже писала.
Відповідно, дуже велике питання - чи можна довіряти порадам з таких сайтів. Якщо хочете - спробуйте, ризикніть своїм здоров'ям. А я не буду.
До речі, ось цікаве відео, яке вразило мене не менше цих сайтів:
Всім удачі і хорошого робочого тижня!
Наталя Брянцева
- являє собою безбарвні моноклінні гігроскопічні кристали, легко розчинні у воді, обмежено - в етиловому спирті і діетиловому ефірі, нерозчинні в хлороформі, петролейном ефірі і бензолі.Хімічна формула: З 2 Н 2 O 4
 Застосування щавлевої кислоти.
Застосування щавлевої кислоти.
- у хімічній промисловості (органічний синтез, при виробництві пластмас, чорнила, в синтезі барвників, як компонент піротехнічних складів);
- у хімічній металургії (як компонент складів для очищення металів від іржі, накипу, оксидів); - в аналітичній хімії (як осадителя рідкоземельних елементів);
- в мікроскопії (в якості відбілювача зрізів);
- у текстильній та шкіряній промисловості (протрава в ситцедрукуванні і при фарбуванні вовни і шовку, для дублення шкіри);
- при виробництві синтетичних миючих засобів (як відбілюючого і дезинфікуючий засіб, засоби для чищення та видалення сечового каменю, солей жорсткості та іржі);
- в косметиці (як активна добавка в відбілюючих кремах і кремах від веснянок);
- в системах очищення води (хімічний спосіб очищення і зниження жорсткості води, очищення теплоносіїв на АЕС);
- в медицині і фармацевтиці.
Вимоги безпеки.
Щавлева кислота - горюча речовина, в який осів стані пил щавлевої кислоти пожежонебезпечна, за ступенем впливу на організм відноситься до речовин 2-го класу небезпеки.
Володіє сильним подразнюють шкіру, слизові оболонки очей і верхніх дихальних шляхів. Щавлева кислота і її солі токсичні. При роботі з щавлевої кислотою слід застосовувати ЗІЗ.
Упаковка, транспортування та зберігання.
Щавлева кислота технічна упаковується в мішки поліетиленові або в мішки, виготовлені з поліетиленової плівки з кольоровим друком. Так само може упаковуватися в фанерні барабани з плівковим мішком-вкладишем або м'які спеціалізовані контейнери разового використання.
Щавлеву кислоту транспортують усіма видами транспорту. Зберігають в упаковці виробника в закритих, вентильованих складських приміщеннях на піддонах.
Гарантійний термін зберігання - 6 місяців з дня виготовлення.
Щавлева кислота (етандіовая кислота) - двухосновная гранична карбонова кислота.
Брутто-формула: З 2 Н 2 O 4.
Структурна формула:
H O O O O H
Безбарвні моноклінні гігроскопічні кристали, легко розчинні у воді, обмежено - в етиловому спирті і діетиловому ефірі, нерозчинні в хлороформі, петролейном ефірі і бензолі. Належить до сильних органічних кислот. Володіє усіма хімічними властивостями, характерними для карбонових кислот. Солі та ефіри щавлевої кислоти називаються оксалатами. Щавлева кислота утворює кислі і середні ефіри, аміди, хлорангидрид. Щільність 1,36 г / см 3. Температура плавлення - 189,5 ° C, температура сублімації - 125 ° C, температура розкладання - 100-130 ° C, температура декарбоксилирования - 166-180 ° C. При контакті з гарячими поверхнями або вогнем щавлева кислота розпадається, утворюючи мурашину кислоту і оксид вуглецю. Бурхливо реагує з сильними окислювачами, що породжує небезпеку загоряння і вибуху. Реагує з деякими сполуками срібла з утворенням вибухових оксалатів срібла.
Виробництво рідкоземельних металів є галуззю, яка споживає найбільші обсяги щавлевої кислоти. Згідно зі статистичними даними для виробництва 1-ї тонни редкоземельного металу потрібно 1 тонна щавлевої кислоти. На другому місці по споживанню знаходиться фармацевтична промисловість. Сумарна частка споживання двох вищевказаних галузей становить 68% світового споживання щавлевої кислоти.
Крім того щавлева кислота застосовується в лакофарбовій промисловості (як каталізатор затвердіння резольних покриттів); в системах очищення води (хімічний спосіб очищення і зниження жорсткості води, очищення теплоносіїв на АЕС); в хімічній промисловості (органічний синтез, при виробництві пластмас, чорнила, в синтезі барвників, як компонент піротехнічних складів); в хімічній металургії (як компонент складів для очищення металів від іржі, накипу, оксидів); в аналітичній хімії (як осадителя рідкоземельних елементів); в мікроскопії (в якості відбілювача зрізів); при виробництві синтетичних миючих засобів (як відбілюючого і дезинфікуючий засіб, засоби для чищення та видалення сечового каменю, солей жорсткості та іржі); в текстильній і шкіряній промисловості (протрава в ситцедрукуванні і при фарбуванні вовни і шовку, для дублення шкіри).

Вороніння або оксидування стали представляє собою процес утворення тонкої мелкокріталліческой і мелкопористой оксидної плівки на поверхні сталевих деталей. Воронінням стали вбивають двох зайців: деталі набувають естетичний гарний вигляд і отримують довічну захист від корозії.
Щавлева кислота входить до складу електроліту для вороніння стали. Особливістю воронения із застосуванням щавлевої кислоти є синьо-чорний колір получающейся оксидної плівки. Електроліт складається тільки з води і щавлевої кислоти. На 100 кг води використовується 0,3 кг щавлевої кислоти.
Електролітичне воронение стали проводять під дією електричного струму щільністю 1-1,5 А / дм 2, напругою 6-8 В. Температура розчину електроліту в режимі роботи 25 ° С. Тривалість обробки 90-100 хв. Як анод використовують свінцовую пластину, площа якої в 1,5 рази більше площі деталі. Закінчивши оксидування деталь обробляють просушуванням при температурі 100-110 ° С.

Анодне оксидування алюмінію - процес отримання на алюмінії оксидної плівки хімічно або електрохімічно з розчинів кислот і лугів.
При анодуванні в щавлевокислого електроліті виходять плівки, що володіють хорошими електроізоляційними властивостями. Вони непрозорі, пофарбовані в декоративні золотисті тони. У цьому електроліті можна обробляти ливарні сплави алюмінію, що містять до 5% міді або 4% кремнію. Анодування ведеться на постійному або змінної струмі. Анодування постійним струмом виробляють в електроліті складу 3-5 кгщавелевой кислоти на 100 кг води. Режим роботи: температура електроліту 15-25 ° С, анодная щільність струму 1-2 А / дм 2, напруга на ванні 40-60 В (до кінця електролізу досягає 60-70В). Для отримання твердих плівок з хорошими електроізоляційними властивостями їх товщина повинна бути не менше 25-40 мкм. Шкідливими домішками, погіршують якість анодування, є хлор і алюміній. Їх допустима концентрація в електроліті становить відповідно 0,04 г / л і 30 г / л.

Відбілювання деревини зазвичай виробляють перед фарбуванням для видалення плям, отримання більш світлої поверхні. Крім того, після відбілювання деревина рівномірніше і чистіше забарвлюється.
Щавлеву кислоту (10% -ний розчин) наносять на відбілюючі поверхню, попередньо змочену 20% -ним розчином гідросульфіту натрію. Не більше ніж через 5 хв нанесені склади змивають звичайною водою.
Для світлих порід - липи, берези, клена, тополі - рекомендується розчин щавлевої кислоти (1,5-6 кг) в кип'яченій воді (100 кг).
Для прискореного відбілювання можна скористатися наступним складом (кг): сірчаної кислоти - 20; щавлевої кислоти - 15; перекису натрію - 25 (або перекису водню - 10); води - 1000.

Щавлева кислота легко усуває водорості, молюски, мідії, вапно, іржу з підводної частини судна, двигуна, вала. Для цього її просто наносять і залишають на деякий час. Потім змивають водою.
Щавлева кислота легко видаляє стійкі забруднення, такі як пил, чорні точки плям оксидів (на алюмінієвих човнах), іржу і машинне масло, вапняний наліт з поверхні гелькоата, пластика, металу і лакованих поверхонь. Дерев'яні судна щавлева кислота захищає від цвілі.

Є ефективним засобом при варроатозе бджіл на пасіках (захворювання бджіл кліщем Варроа). Загибель бджіл і маток після обробки не відзначається.
Обробка проводиться одноразово спеціально підготовленим розчином методом поливання бджіл в міжрамочного просторах з розрахунку 5 мл розчину на вуличку.
Робочий розчин готується може бути приготований одним з двох способів:
1) шляхом змішування 100 г цукру, 100 мл води і 7,5 г щавлевої кислоти (ГОСТ 22180-76) до повного розчинення. Акарицидна ефективність одноразової обробки щавлевої кислотою становить 85% через чотири дні після обробки.
2) щавлева кислота в концентрації 3,75%, застосовувана в 20% -ному сиропі. Ефективність обробки бджолиних сімей щавлевої кислотою становить 95% і не поступається ефективності Бівар (92%).
Економічний ефект від застосування щавлевої кислоти методом поливання бджіл в межрамочном просторі, в порівнянні з обробкою Бівар, які мають той же спосіб застосування, обумовлений різницею у вартості препаратів, а також тим, що обробку кислотою проводять одноразово, а Бівар - дворазово. Загальні витрати на одноразову обробку щавлевої кислотою менше ніж на дворазову обробку Бівар більш ніж в два рази (з урахуванням витрат праці, цукру і кислоти).
Щавлева кислота - високоефективний екологічно безпечний метод боротьби з варроатозом. За акарицидних ефективності він не поступається рекомендованим в цей період препаратів бипином і Бівар. Обробка щавлевої кислотою даним методом не робить негативного впливу на бджолині сім'ї. Застосування щавлевої кислоти дозволяє підвищити санітарні якості одержуваних продуктів.
![]()
Щавлева кислота добре очищає метали й СПАР з заліза, цинку, міді. При цьому зберігає фарбу і метал. Щавлева кислота використовується працівниками музеїв та археологами для очищення монет, пряжок, касок, гільз, посуду і багато іншого.
Для чищення використовується 5% розчин щавлевої кислоти (50 грам на 1 літр). Залежно від стану предмета - чистка щавлевої кислотою триває 20-40 хвилин в теплому розчині і до 3 діб в холодному розчині. Найчастіше використовують використовують пластикову ємність з підігрівом на водяній бані. Здатність відпрацьованого розчину щавлевої кислоти до реакції з часом слабшає. Це залежить від кількості вилучених розчином окислів.

Жорсткість води залежить від кількості солей кальцію і магнію. Щавлева кислота вступає в реакцію з цими солями. Продукти цієї реакції випадають в осад.
Пом'якшена вода не засолівает грунт і підвищує врожайність овочів і фруктів, покращує розвиток кімнатних рослин.
Для пом'якшення води використовується 1% розчин щавлевої кислоти (10 грам на 1 літр). При кімнатній температурі досить доби для відстою води. Візуально вода стане прозорою. Після чого осад відокремлюють. Для цього воду обережно зливають. Осад з солями небезпеки не представляє, але і подальшого використання в господарстві не підлягає.
Щавлева кислота є сильною кислотою, яка у твердій формі або в концентрованих розчинах може викликати опіки шкіри, очей або слизових оболонок; навіть низькі концентрації щавлевої кислоти (від 5 до 10%) при тривалому впливі є подразником. Були зареєстровані випадки загибелі людей після ковтання всього лише 5 г щавлевої кислоти. Симптоми отруєння з'являються швидко: шоковий стан, колапс, конвульсії. У подібних випадках спостерігається ураження нирок з осадженням щавлевокислого кальцію в ниркових каналах. Конвульсії можуть бути результатом гіпокальцемії. Тривала дія на шкіру розчинів щавлевої кислоти або щавлевокислого калію викликає місцеві болі, ціаноз в пальцях і навіть гангренозние зміни. Очевидно, це відбувається через локального всмоктування щавлевої кислоти, в результаті чого розвивається артрит. Хронічні системні захворювання від вдихання пилу щавлевої кислоти зустрічаються вкрай рідко, хоча в літературі описаний випадок, коли у людини, що піддавався впливу гарячої пари щавлевої кислоти (ймовірно, що містили аерозоль щавлевої кислоти), відзначалися такі симптоми, як втрата ваги і хронічне запалення верхніх дихальних шляхів . Через сильний кислотного впливу пилу щавлевої кислоти її вміст в повітрі виробничих приміщень повинно ретельно контролюватися і не перевищувати безпечні для здоров'я концентрації.
У промисловості щавлеву кислоту отримують окисленням вуглеводів, спиртів і гліколів сумішшю HNO 3 і H 2 SO 4 в присутності V 2 O 5, або окисленням етилену і ацетилену HNO 3 в присутності PdCl 2 або Pd (NO 3) 2, а також окисленням пропилену рідким NO 2.
Федеральне агентство з освіти
Державна освітня установа вищої професійної освіти
Волгоградського державного технічного університету
(ВолгГТУ)
Кафедра «Технологія високомолекулярних і волокнистих матеріалів»
семестрова робота
з дисципліни «Основи хімічний процесів»
Тема: «Характеристика процесів, що протікають при синтезі щавлевої кислоти. Розрахунок матеріального і теплового балансу ».
Волгоград 2011
Хімічні властивості.
Фізичні властивості.
Способи отримання.
застосування
Ринок збуту
ГОСТи для продажу
матеріальний баланс
тепловий баланс
Хімічні властивості:
Щавлева кислота (етандіовая кислота) З 2 H 2 O 4 - двухосновная гранична карбонова кислота. Належить до сильних органічних кислот. Володіє усіма хімічними властивостями, характерними для карбонових кислот. Солі та ефіри щавлевої кислоти називаються оксалатами. У природі міститься в щавлі і деяких інших рослинах у вигляді оксалатів калію і кальцію.
Вперше щавлева кислота синтезована в 1842 році німецьким хіміком Фрідріхом Велером з диціану. Щавлева кислота (або оксалат-іон C 2 O 4 2-) є відновником (знебарвлює розчин KMnO4).
Щавлева кислота легко розчинна у воді і спирті. Це відносно сильна органічна кислота (3 клас небезпеки), ноос-СООН, являє собою безбарвні гігроскопічні кристали, легко розчинна у воді, обмежено - в етиловому спирті і діетиловому ефірі, нерастворима в хлороформі, петролейном ефірі і бензолі. Утворює дигідрат складу З 2 H 2 O 4 * 2Н 2 О. Горюча речовина, в який осів стані пожежонебезпечна. Володіє сильним подразнюють шкіру, слизові оболонки очей і верхніх дихальних шляхів.
Щавлева кислота має хімічними властивостями, характерними для карбонових кислот, утворюючи два ряди похідних. Солі та ефіри щавлевої кислоти називаються оксалатами. Щавлева кислота утворює кислі і середні ефіри, аміди, хлорангидрид.
Щавлева кислота міститься в щавлі і ревені у вигляді оксалату калію.
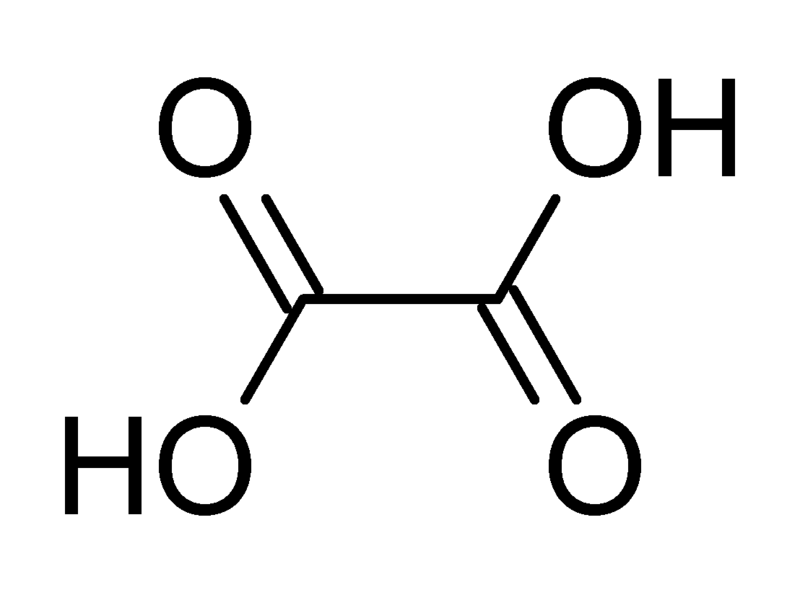
Ця кислота дуже поширена в рослинному світі - у вигляді солей вона міститься в листі щавлю, кислиці, ревеню тощо Солі та ефіри це кислоти мають тривіальне назва - оксалати (від грец. «Oxalis» - щавель).
проявляє загальні властивості кислот, так. як має функціональну карбоксильну групу. Реакція солеутворення доводить кислотні властивості мурашиної кислоти. При цьому утворюються солі - Форміат.
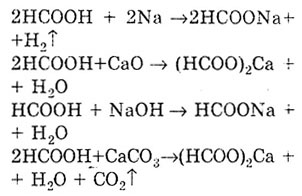
Як і всі карбонові кислоти, мурашина кислота утворює складні ефіри.
Реакція етерифікації:
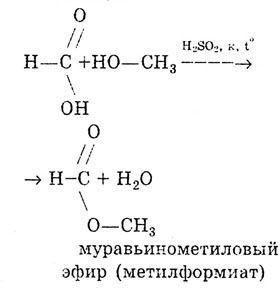
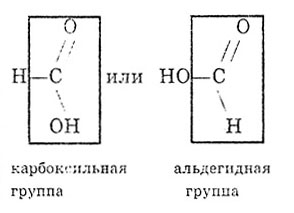
Від інших карбонових кислот мурашина кислота відрізняється тим, що карбоксильна група в ній пов'язана не з вуглеводневим радикалом, а з атомом водню. Тому мурашину кислоту можна розглядати і як кислоту, і як альдегід:
Подібно альдегідів, мурашина кислота може окислюватися:
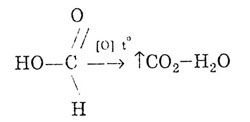
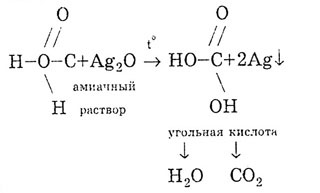
Мурашина кислота дає реакцію «срібного дзеркала»:
Мурашина кислота розкладається при нагріванні:
![]()
мурашина кислота відноситься до гомологічного ряду одноосновних карбонових кислот
Фізичні властивості:
Температура сублімації: см. Примітки ° C
Температура плавлення: 102 ° C
Відносна щільність (вода \u003d 1): 1.7
Розчинність в воді, г / 100 мл: 10
Тиск пару, Па при 30 ° C: см. Примітки
Відносна щільність пари (повітря \u003d 1): 3.1
Щавлева кислота - одна з найсильніших карбонових кислот, далеко перевершує за силою свої гомологи.
Етандіовая кислота проявляє відновні властивості: в подкисленном розчині перманганату калію вона окислюється до оксиду вуглецю (IV) і води.
При нагріванні в присутності сірчаної кислоти відбувається декарбоксилювання, і виходить оксид вуглецю (IV) і мурашина кислота.
Температури кипіння жирних кислот нормального будови закономірно зростають у міру збільшення числа вуглецевих атомів. Встановлено, що молекули кислот асоційовані подібно до того, як асоційовані молекули води або спиртів. Нижчі кислоти добре перегоняются з водяною парою, тому їх зазвичай називають летючими жирними кислотами.
Температури плавлення одноосновних кислот у міру збільшення в їх молекулах числа вуглецевих атомів в загальному також зростають; але при цьому спостерігається наступна закономірність: кислоти з нормальною ланцюгом, що мають парне число вуглецевих атомів, плавляться зазвичай при більш високій температурі, ніж попередній і наступний члени гомологічного ряду, що мають непарну кількість вуглецевих атомів.
ХІМІЧНА НЕБЕЗПЕКА:
Речовина розкладається при швидкому нагріванні вище приблизно 150 ° C з утворенням токсичного газу. Водний розчин є кислотою середньої сили яка бурхливо реагує з сильними основами. Реагує бурхливо з окислювачами приводячи до небезпеки виникнення пожежі та вибуху. Реагує з сріблом з утворенням вибухонебезпечних продуктів.
Застосування.
Щавлеву кислоту і її солі застосовують у текстильній та шкіряній промисловості в якості протрави; як компонент анодних ванн для осадження Al, Ti і Sn покриттів; як реагент в аналітичній і органічної хімії; компонент складів для очищення металів від іржі і оксидів; для осадження рідкісноземельних елементів. Оксамід - стабілізатор нітратів целюлози, ціан - реагент в органічному синтезі, оксалілхлорид - хлорує, хлоркарбонілірующій і зшиває реагент в органічному синтезі. Діалкілоксалати, головним чином діетілоксалат і дібутілоксалат, застосовують як розчинники целюлози; деякі ефіри щавлевої кислоти і заміщених фенолів - в якості хемілюмінесцентних реагентів.
Щавлева кислота використовується для полірування металів, у деревообробній промисловості, при очищенні урану
Області застосування щавлевої кислоти і її солей (оксалатів):
в хімічній промисловості (органічний синтез, при виробництві пластмас, чорнила, в синтезі барвників, як компонент піротехнічних складів);
в хімічній металургії (як компонент складів для очищення металів від іржі, накипу, оксидів);
в аналітичній хімії (як осадителя рідкоземельних елементів);
в мікроскопії (в якості відбілювача зрізів);
в текстильній і шкіряній промисловості (протрава в ситцедрукуванні і при фарбуванні вовни і шовку, для дублення шкіри);
при виробництві синтетичних миючих засобів (як відбілюючого і дезинфікуючий засіб, засоби для чищення та видалення сечового каменю, солей жорсткості та іржі);
в косметиці (як активна добавка в відбілюючих кремах і кремах від веснянок);
в системах очищення води (хімічний спосіб очищення і зниження жорсткості води, очищення теплоносіїв на АЕС);
в медицині і фармацевтиці.
Способи отримання:
1) Як побічний продукт у виробництві оцтової кислоти Рідкофазний окисленням бутану.
2) Окислення метанолу:
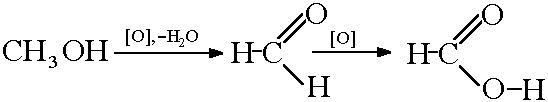
Реакцією монооксиду вуглецю з гідроксидом натрію:
NaOH + CO → HCOONa → (+ H3SO4, -Na2SO4) HCOOH
Це основний промисловий метод, який здійснюють у дві стадії: на першій стадії монооксид вуглецю під тиском 0,6-0,8 МПа пропускають через нагрітий до 120-130 ° C гідроскід натрію; на другій стадії проводять обробку форміату натрію сірчаною кислотою і вакуумну перегонку продукту.
Розкладанням гліцеринових ефірів щавлевої кислоти. Для цього нагрівають безводний гліцерин зі щавлевої кислотою, при цьому відганяється вода і утворюються щавлеві ефіри. При подальшому нагріванні ефіри розкладаються, виділяючи вуглекислий газ, причому утворюються мурашині ефіри, які після розкладання водою дають мурашину кислоту і гліцерин.
| Статті по темі: | |
|
Інтер'єр, декор, зберігання, ідея для будинку, скандинавський стиль, корзина, в'язана кошик, в'язання гачком, своїми руками diy, handmade, interior, decor, knit, knitting box
Скоро-скоро прийде літо і буде ділитися з нами всіма, що у нього є: ... Щавлева кислота: що нам про неї відомо
Привіт всім! Багато хто знає, що щавлева кислота викликає утворення ... Що таке стартап і хто такі стартаперів - як створити з мінімальними вкладеннями і приклади найбільш вдалих
Переклад Даний посібник - серія вважаються класичними постів ... | |