вибір читачів
Популярні статті
Вступ
У вашій квартирі ремонт, і необхідно купити керамічну плитку. У магазині, довго перебираючи різні варіанти форм і забарвлень, ви знайшли підходящу і, прямуючи до каси, мигцем глянули на ту частину упаковки з плиткою, де написано її складу. Майже всі інгредієнти знайомі, але один з них викликав у вас здивування - оксид кремнію. Природно, ви захочете дізнатися про нього більше. Сьогодні я постараюся задовольнити ваш інтерес.
визначення
Кремній має змінну валентність, і через це в хімії відомо два його сполуки з киснем. Сьогодні ми розглянемо вищий оксид кремнію, в якому останній має валентність IV.
Назва
У різних джерелах його можуть обізвати діоксидом кремнію, кремнеземом або оксидом силіцію.
властивості
Він є кислотним оксидом, якому притаманні твердість і міцність. Якщо нагріти його і будь-яку луг / основний оксид, то вони будуть взаємодіяти один з одним. Це з'єднання кремнію - стеклообразующего, т. Е. З нього може вийти переохолоджену розплав - скло.  Також (в чистому вигляді) він не пропускає електричний струм (є діелектриком). У оксиду кремнію атомна кристалічна решітка. Він є стійким до дії кислот, проте виняток становлять плавикова і газоподібний фтороводород. Продукти реакції з останнім - фторид кремнію і вода. Якщо ж другий реагент - розчин фтороводорода, то її продуктами будуть гексафторкремніевая кислота і та ж вода. Якщо оксид кремнію (IV) сплавити з лугом / основним оксидом / карбонатом будь-якого активного металу, продуктом реакції стане сіль кремнієвих кислот - силікат, з них розчинні тільки силікати калію і натрію. Продукти взаємодії будь-якого з останніх з водою звуться рідкого скла. У них сильно лужне середовище, причина цього - гідроліз. Гідролізовані силікати утворюють не істинні, а колоїдні розчини. Якщо розчини силікатів калію або натрію трохи окислити, відбудеться випадання студенистого білого осаду, який складають гідратованих кремнієві кислоти.
Також (в чистому вигляді) він не пропускає електричний струм (є діелектриком). У оксиду кремнію атомна кристалічна решітка. Він є стійким до дії кислот, проте виняток становлять плавикова і газоподібний фтороводород. Продукти реакції з останнім - фторид кремнію і вода. Якщо ж другий реагент - розчин фтороводорода, то її продуктами будуть гексафторкремніевая кислота і та ж вода. Якщо оксид кремнію (IV) сплавити з лугом / основним оксидом / карбонатом будь-якого активного металу, продуктом реакції стане сіль кремнієвих кислот - силікат, з них розчинні тільки силікати калію і натрію. Продукти взаємодії будь-якого з останніх з водою звуться рідкого скла. У них сильно лужне середовище, причина цього - гідроліз. Гідролізовані силікати утворюють не істинні, а колоїдні розчини. Якщо розчини силікатів калію або натрію трохи окислити, відбудеться випадання студенистого білого осаду, який складають гідратованих кремнієві кислоти.
отримання
У промисловості оксид кремнію отримують, нагріваючи кремній в кисневому середовищі. Він окислюється і утворює шуканий продукт. Також його добувають за допомогою термічного оксидування. У лабораторії оксид кремнію отримують при дії будь-яких кислот на розчинну силікат, для цього підходить навіть слабка оцтова. Наприклад, якщо з'єднати її і силікат натрію, продуктом реакції стане ацетат натрію і кремнієва кислота. Тут же відбудеться розкладання останньої, і продуктами її розпаду стануть вода і шуканий оксид.
 застосування
застосування
За допомогою оксиду кремнію виробляють скло, кераміку, абразиви, бетонні вироби, а також отримують сам кремній. Ще він виконує роль наповнювача в галузі виробництва гуми. Кристали аморфної модифікації оксиду кремнію - кварцового скла - мають п'єзоелектричні властивості, і цим користуються творці радіотехніки, ультразвукових установок і запальничок. Силікати і кремнезему - майже 90% маси літосфери. Також оксид кремнію відомий як харчова добавка E551. Це його аморфна непориста різновид. Вона запобігає злежування і комкование їжі, в фармацевтиці використовується як допоміжна речовина і лікарський препарат-ентеросорбент. Плівки даного оксиду служать ізолятором, коли виробляють мікросхеми та інші електронні компоненти. Також з їх допомогою створюють волоконно-оптичні кабелі. А нагрівальні елементи електронної сигарети були б неможливі без кремнеземне нитки.
висновок
Ось як широко використовується даний оксид. І щоб побачити його, не потрібно бігти в магазин і заради цікавості розглядати цемент і бетон. Природний оксид кремнію знаходиться у нас під ногами - це звичайний пісок. Виявляється, і він може бути корисним.
Кремній. Будова атома, кристалічний кремній, його властивості та застосування. Оксид кремнію (IV), його природні різновиди. Силікати. Значення сполук кремнію в живій і неживій природі. Поняття про силікатної промисловості.
Тема: Кремній. Будова атома, кристалічний кремній, його властивості та застосування. Оксид кремнію (IV), його природні різновиди. Силікати. Значення сполук кремнію в живій і неживій природі. Поняття про силікатної промисловості.
план
1. Будова атома
2. Фізичні та хімічні властивості кремнію.
3. Отримання кремнієвої кислоти.
4. Силікати. Будівельні матеріали.
література:
Кремній відкрив і отримав в 1823 році шведський хімік Йенс Якоб Берцеліус. Другий за поширеністю елемент в земній корі після кисню (27,6% по масі). Зустрічається в з'єднаннях.
Будова атома кремнію в основному стані:
1s 2 2s 2 2p 6 3s 2 3p 2
Будова атома кремнію в збудженому стані:
1s 2 2s 2 2p 6 3s 1 3p 3
кристалічний кремній - темно-сіра речовина з металевим блиском, велика твердість, крихкий, напівпровідник; ρ = 2,33 г / см3 , T ° пл. = 1415 ° C; t ° кип. = 2680 ° C. Має алмазоподобную структуру і утворює міцні ковалентні зв'язки. Інертний.
аморфний кремній- бурий порошок, гігроскопічний, алмазоподібні структура, ρ = 2 г / см3 , Більш реакционноспособен.
отримання кремнію
У промисловості - нагрівання вугілля з піском:
2C + SiO 2 t˚ → Si + 2CО
В лабораторії - нагрівання піску з магнієм :
2Mg + SiO 2 t˚ → Si + 2MgO
Хімічні властивості
Типовий неметалл, інертний.
Як відновник:
Si 0 + O 2 t˚ → Si +4 O 2
Si 0 + 2F 2 → SiF 4
Si 0 + C t˚ → Si +4 С
(SiC - карборунд - твердий; використовується для точки, шліфування)
Сілан (SiH 4 ) Отримують розкладанням силіцидів металів кислотою.
Mg 2 Si + 2H 2 SO 4 → SiH 4 + 2MgSO 4
3Si + 4HNO 3 + 18HF → 3H 2 + 4NO + 8H 2 O
Як окислювач:
Si 0 + 2Mg t˚ → Mg 2 Si -4
Застосування кремнію:
Кремній широко використовується в електроніці як напівпровідник. Добавки кремнію до сплавів підвищують їх корозійну стійкість. Силікати, алюмосилікати і кремнезем - основна сировина для виробництва скла та кераміки, а також для будівельної промисловості.
Сілан - SiH 4
Фізичні властивості: Безбарвний газ, отруйний, t ° пл. = -185 ° C, t ° кип. = -112 ° C
отримання : Mg 2 Si + 4HCl → 2MgCl 2 + SiH 4
Хімічні властивості:
Оксид кремнію (IV) - (SiO2) n
SiO 2 - кварц, гірський кришталь, аметист
,
агат, яшма, опал
, Кремнезем (основна частина піску). Кристалічна решітка оксиду кремнію (IV) - атомна і має таку будову: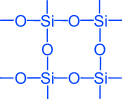

Al 2 O 3 2SiO 2 2H 2 O - каолініт (основна частина глини)
K 2 O Al 2 O 3 6SiO 2 - ортоклаз (польовий шпат)
Фізичні властивості:Тверда, кристалічна, тугоплавка речовина, t ° пл. = 1 728 ° C, t ° кип. = 2590 ° С
Хімічні властивості:
Кислотний оксид. При сплаві взаємодіє з основними оксидами, лугами, а також з карбонатами лужних і лужноземельних металів.
SiO 2 + CaO t˚ → CaSiO 3
SiO 2 + 2NaOH t˚ → Na 2 SiO 3 + H 2 О
SiO 2 + CaCO 3 t˚ → CaSiO 3 + CO 2
SiO 2 + K 2 CO 3 t˚ → K 2 SiO 3 + CO 2
SiO 2 + 4HF t˚ → SiF 4 + 2H 2 О
SiO 2 + 6HF t˚ → H 2 (Гексафторкремніевая кислота) + 2H 2 О)
(Реакції лежать в основі процесу травлення скла).
застосування:
2. Отримання кремнієвої кислоти.
x SiO 2 y H 2 Про 
x = 1, y = 1 H 2 SiO 3 - метакремнієва кислота
x = 1, y = 2 H 4 SiO 4 - ортокремнієвої кислота і т.д.
Фізичні властивості: H 2 SiO 3 - дуже слабка (слабше вугільної), нетривка, в воді малорастворима (утворює колоїдний розчин), не має кислого смаку.
отримання:
Дія сильних кислот на силікати - Na2 SiO 3 + 2HCl → 2NaCl + H 2 SiO 3 ↓
(Отримання гелю кремнієвої кислоти, отримання кремнієвої кислоти)
Хімічні властивості:
Солі кремнієвої кислоти називаються -силікати.
Na 2 SiO 3 + H 2 O + CO 2 = Na 2 CO 3 + H 2 SiO 3
Na 2 SiO 3 + CaCl 2 = 2NaCl + CaSiO 3 ↓
(K 2 O Al 2 O 3 6SiO 2) (польовий шпат) + CO 2 + 2H 2 O → (Al 2 O 3 2SiO 2 2H 2 O) (каолініт (глина)) + 4SiO2 (Кремнезем (пісок)) + K2 CO 3
У пробірку з розчином силікату Калію додамо р-р соляної кислоти розведеної. У пробірці утворилася біла напівтверда маса - кремнієва кислота
Na 2 SiO 3 + НCl = 2NaCl + Н 2 SiO 3 
Застосування сполук кремнію
Природні сполуки кремнію - пісок (SiO2 ) І силікати використовуються для виробництва кераміки, скла і цементу.
Склад звичайного віконного скла наближено виражається формулою Na2О СаО 6 SіО2 . Скло отримують сплавляння в спеціальних печах суміші соди Na2 СО 3 , Вапняку СаСО3 і білого піску SіО2.
3. Силікати. Будівельні матеріали.

кераміка |
|
Фарфор = Каолін + глина + кварц + польовий шпат. Родина порцеляни - Китай, де фарфор відомий вже в 220г. У 1746 р - налагоджено виробництво порцеляни в Росії
| фаянс - від назви італійського міста Фаенца. Де в 14-15веках було розвинене керамічне ремісництво. Фаянс - відрізняється від порцеляни великим вмістом глини (85%), більш низькою температурою випалу.
|
Скло - крихкий, прозорий матеріал, здатний розм'якшуватися і при застиганні приймає будь-яку форму. Скло отримують варінням шихти (Сировинної суміші, що складається з піску, соди і вапняку) в спеціальних скловарних печах.


Основні реакції, що протікають при плавці шихти
1. Na 2 CO 3 + SiO 2 = Na 2 SiO 3 + CO 2
2. CaCO 3 + SiO 2 = CaSiO 3 + CO 2
3. Na 2 SiO 3 + CaSiO 3 + 4SiO 2 = Na 2 O * CaO * 6SiO 2 - формула віконного скла
Силікати складу R2 Про nSiO 2, де R 2 Про - оксиди натрію або калію, називаються розчинним склом, а їх концентровані розчини - рідким склом.
Часто у виробництві скла соду замінюють сульфатом натрію і вугіллям. В цьому випадку силікат натрію утворюється за рівнянням реакції:
При додаванні оксиду свинцю отримують кришталь. Для виготовлення спеціального скла змінюють склад вихідної суміші. Замінюючи соду Na2 СО 3 поташем К 2 СО 3 , Отримують тугоплавкое скло (для хімічного посуду). Добавки оксидів металів до вихідний суміші додають склу різного фарбування: оксид хрому - (ІІІ) Сг2 O 3 , - зеленого, оксид кобальту (ІІ) СоО - синього, оксид марганцю (IV) МпО2 - червоно - лілового.
цемент 

Звичайний силікатний цемент - зеленувато сірий порошок, який при змішуванні з водою твердне на повітрі (або в воді), перетворюючись в каменеподібним масу. Зазвичай його отримують прожарювання (1400-1600 ° С) до спікання сировинної суміші, яка складається з вапняку і глини. Прожарювання здійснюється в спеціальних циліндричних оборотних печах.клінкер - кульки темно-сірого кольору отримують спіканням глини і вапняку в спеціальних печах, що обертаються. Регулюючи склад суміші, отримують різні види цементу - швидко твердне, морозостійкі, корозійностійких. З суміші цементу, води і наповнювачів (пісок, гравій, щебінь, шлак), після їх затвердіння отримують штучний камінь - бетон. Суміш цих матеріалів до затвердіння називається бетонною сумішшю. При затвердінні цементне тісто пов'язує зерна наповнювачів. Затвердіння відбувається навіть у воді. Бетон зі сталевою арматурою (внутрішнім каркасом) називається залізобетоном.
Завдання для закріплення:
Si → SiO 2 → Na 2 SiO 3 → H 2 SiO 3 → SiO 2
Домашнє завдання
Література 3.
опрацювати §30-33
Кремній. Сілан, силіциди, Оксид кремнію (IV). Кремнієві кислоти, силікати
8.1. Кремній. Сілан, силіциди
Кремній - аналог вуглецю, але його неметалеві властивості виражені слабкіше, ніж у вуглецю.
Для кремнію більш характерно sp 3 -гібрідное стан, тому в з'єднаннях кремній може проявляти ступені окиснення 4 і -4.
Кремній - найпоширеніший після кисню елемент на Землі. Масова частка кремнію в земній корі становить 27,6%. У природі кремній поширений у вигляді оксиду SiO 2, званого також кремнеземом, який зустрічається у вигляді піску, кварцу. Іншу групу природних сполук кремнію становлять силікати - похідні кремнієвої кислоти. Найбільш поширені алюмосилікати, до яких відносяться польовий шпат (альбіт) NaAlSi 3 O 8, польовий шпат (ортоклаз) KAlSi 3 O 8\u003e глина (каолін) Аl 2 О 3 2SiO 2 2Н 2 О, нефелин Na 3 K 4 та ін. Вони утворюють оболонку земної кори. З'єднання кремнію містяться в організмах рослин і тварин.
отримання
У промисловості кремній отримують відновленням SiO 2 коксом в електричних печах:
SiO 2 2С = S 2CO
У лабораторії в якості відновників використовують магній або алюміній:
SiO 2 2Mg = Si 2MgO 3SiO 2 4Al = 3Si 2Al 2 O 2
Найбільш чистий кремній отримують відновленням тетрахлориду кремнію воднем при 1200 ° С: SiCl 4 2Н 2 = Si 4HCl
^ Фізичні властивості
Кристалічний кремній - речовина темно-сірого кольору зі сталевим блиском. Структура кремнію аналогічна структурі алмазу. У його кристалі кожен атом оточений Тетраедрично чотирма іншими і пов'язаний з ними ковалентним зв'язком, яка значно слабкіше, ніж між атомами вуглецю в алмазі.
У кристалі кремнію навіть при звичайних умовах частина ковалентних зв'язків руйнується. Тому в ньому є вільні електрони, які обумовлюють невелику електричну провідність. При висвітленні і нагріванні збільшується число об'єктів, що руйнуються зв'язків, а значить, збільшується число вільних електронів і зростає електрична провідність. Так слід пояснювати напівпровідникові властивості кремнію. Кремній дуже крихкий, його щільність 2,33 г / см 3. Як і вугілля, кремній відноситься до тугоплавким речовин.
Кремній складається з трьох стабільних ізотопів: 28 14 Si (92,27%),
29 14 Si (4,68%) і 30 14 Si (3,05%).
^ Хімічні властивості
за хімічними властивостями кремній, як і вуглець, є неметаллом, але його неметаллічность виражена слабше, тому що він має більший атомний радіус. Оскільки у атомів кремнію на зовнішньому енергетичному рівні знаходиться 4 електрона, то для кремнію характерна ступінь окислення як -4, так і 4.
Кремній при звичайних умовах досить інертний, що пояснюється міцністю його кристалічної решітки. Безпосередньо він взаємодіє тільки з фтором:
Si 2F 2 = SiF 4
Подрібнений кремній при нагріванні з киснем згорає в оксид кремнію (IV):
Si О 2 = SiO 2
З хлором кремній реагує при 400-600 ° С:
Si 2Сl 2 = SiCl 4
при дуже високих температурах кремній здатний безпосередньо з'єднуватися з вуглецем і азотом:
3Si 2N 2 = Si 3 N 4
Карбід кремнію SiC (карборунд) має алмазоподобную кристалічну решітку, в якій кожен атом кремнію оточений чотирма атомами вуглецю і навпаки, а ковалентні зв'язки дуже міцні, як в алмазі. Тому по твердості він близький
До алмазу. З карбіду кремнію виготовляють точильні камені та шліфувальні круги.
Кислоти (крім суміші фтороводородной HF і азотної HNO 3) на кремній не діють. Однак він розчиняється в лугах, утворюючи силікат і водень:
Si 2NaOH H 2 O = Na 2 SiO 3 2H 2
Кремній з деякими металами - Sn, Al, Zn, Pb, Au, Ag - хімічно не взаємодіє. З іншими ж металами, наприклад з Mg, Ca, Cu, Fe, Pt, Bi, реагує з утворенням силіцидів:
2Са Si = Ca 2 Si
Силіциди в залежності від структури і властивостей можна розбити на дві групи. До першої відносяться силіциди лужних і лужноземельних металів (Li 4 Si, Ca 2 Si). Вони розкладаються водою і розведеними кислотами з виділенням силанов:
Ca 2 Si 4HCl = 2СаСl 2 SiH 4
Найбільш цікава група металлоподобних силіцидів, утворених перехідними металами. У структурі цих силіцидів ланцюга і шари з атомів кремнію розміщені в кристалічній решітці металу. Це тверді речовини з досить високими температурами плавлення. Дуже важливо, що силіциди що не окислюється навіть при високих температурах. Так, силицид молібдену MoSi 2 не змінюється на повітрі аж до 1600 ° С, що дозволяє використовувати його як нагрівач електричних печей.
Освіта силіцидних шарів на металах широко використовується для захисту від окислення і корозії в різних хімічних реагентах. Багато силіциди є напівпровідниками.
Сілан SiH 4, що виділяється при дії на силицид соляною кислотою, є отруйним газом з неприємним запахом. Відноситься до групи кремневодородов - з'єднанням кремнію з воднем. За будовою молекул кремневодороди подібні вуглеводнів. При кімнатній температурі моносилан SiH 4 і дисилан Si 2 H 6 - газоподібні речовини, інші силани - до останнього відомого Si 8 H 18 - летючі рідини. Вони отруйні і мають неприємний запах. Хімічно менш стійкі, ніж вуглеводні.
Сілани самовоспламеняются на повітрі:
SiH 4 2O 2 = SiO 2 2Н 2 O
Вода розкладає силани:
Si 2 H 6 4Н 2 O = 2SiO 2 7Н 2
Освітою і подальшим розкладанням SiH 4 користуються для отримання чистого кремнію в промисловості напівпровідників.
застосування
Кремній використовується в якості напівпровідника. З нього виготовляють так звані сонячні батареї, що перетворюють світлову енергію в електричну (харчування радіоустановок космічних кораблів). Кремній використовують в металургії для отримання кременистих сталей, що володіють високою жаростійкістю і кислотоупорностью.
^ 8.2. Оксид кремнію (IV)
Оксид кремнію (IV) (кремнезем) - найбільш поширене в земній корі з'єднання, що становить у вигляді різних мінералів 12% її маси. Розрізняють кристалічний і аморфний кремнезем.
1) ^ кристалічний кремнезем - у вигляді мінералу кварцу і його різновидів (гірський кришталь, халцедон, агат, яшма, кремінь); кварц становить основу кварцових пісків, широко використовуваних в будівництві і в силікатної промисловості.
2) ^ аморфний кремнезем - у вигляді мінералу опала складу SiO 2 NН 2 О; землистими формами аморфного кремнезему є діатоміт, трепел (інфузорна земля); прикладом штучного аморфного безводного кремнезему може служити силікагель, який отримують з метасилікат натрію:
Силікагель має розвинену поверхню, тому добре адсорбує вологу.
кварц- дуже тверде, міцне, тугоплавка речовина, температура плавлення 1723 ° С. При швидкому охолодженні розплавленої маси утворюється кварцове скло. З нього виготовляють лабораторний посуд і прилади для наукових досліджень.
Найпростіша формула оксиду кремнію (IV) - SiO 2. Він кристалізується в атомній решітці. Структуру SiO 2 в площинному зображенні можна змалювати таку картину:

Кожен атом кремнію укладений в тетраедр з 4 атомів кисню. При цьому атом кремнію знаходиться в центрі, а по вершинах тетраедра розташовані атоми кисню. Весь шматок кремнезему можна розглядати як кристал, формула якого (Si0 2) n. Така будова оксиду кремнію (IV) обумовлює його високу твердість і тугоплавкость.
Хімічні властивості
У воді SiO 2 практично не розчиняється. Як кислотний оксид, реагує при сплаву з твердими лугами, основними оксидами і карбонатами, утворюючи солі кремнієвої кислоти:
SiO 2 2NaOH = Na 2 SiO 3 Н 2 О
SiO 2 CaO = CaSiO 3
SiO 2 Na 2 CO 3 = Na 2 SiO 3 СО2
Кислоти не діють на SiO 2. Лише фтороводородной кислота поступово розчиняє його:
SiO 2 4HF = SiF 4 2Н 2 O
Ця реакція лежить в основі травлення скла. Розжарювання суміші SiO 2 з вуглецем до 2000 ° С призводить до утворення карбіду кремнію SiC, званого карборундом: SiO 2 2С = SiC 2CO
застосування
Оксид кремнію (IV) широко застосовується в силікатної промисловості при виробництві скла, кераміки, бетонних виробів, силікатної цегли. Чистий кварц незамінний в приладобудуванні. Кристали кварцу є п'єзоелектрик - вони можуть майже без втрат перетворювати електричну енергію в механічну. З дрібних кристалів кварцу і з відходів виробництва п'єзоелектричних пластин отримують кварцове
^ Таблиця 26.
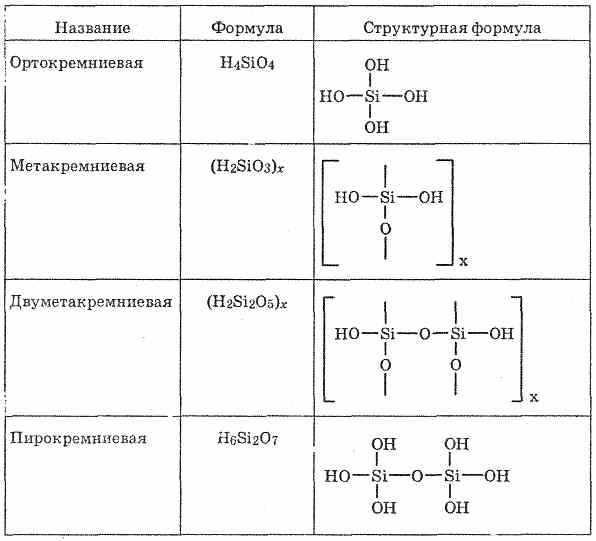
кремнієві кислоти
Скло. Воно прозоро не тільки для видимого світла, але і для ультрафіолетового, що володіє цілющою дією.
^ 8.3. Кремнієві кислоти, силікати
Кремнієві кислоти - сполуки оксиду кремнію (IV) з водою, дуже слабкі кислоти. Співвідношення SiO 2 і Н 2 О в кремнієвих кислотах буває самим різним, тому їх склад зазвичай представляють у вигляді загальної формули «SiO 2 mH 2 O. Кислоти з різними n легко переходять один в одного. У вільному стані виділені ортокремнієвої H 4 SiO 4, метакремнієва H 2 SiO 3 і кілька інших кислот (див. Табл. 26).
Кремнієву кислоту отримують непрямим шляхом, діючи. кислотою на силікат калію або натрію:
Na 2 SiO 3 2HCl = 2NaCl H 2 SiO 3
Кремнієву кислоту можна отримати в чистому вигляді. У водних розчинах вона утворює колоїдний розчин, або золь, який існує дуже малий проміжок часу. Золь далі коагулирует утворюється гель. При висушуванні гелю утворюються продукти з пористою структурою - силикагели, що застосовуються в якості осушувачів і адсорбентів.
H 2 SiO 3 - кислота дуже слабка, в воді малорастворимая. При нагріванні легко розпадається аналогічно вугільної кислоти:
H 2 SiO 3 = H 2 O SiO 2
Будучи двухосновной кислотою, дисоціює ступінчасто:
Н 2 SiO 3 Н НSiO - 3
НSiO-3Н SiO 2 3
Кремнієва кислота слабкіше вугільної.
У водних розчинах вугільна кислота витісняє кремнієву з їх солей:
Na 2 SiO 3 Н 2 O СО 2 = Na 2 CO 3 H 2 SiO 3
Солі кремнієвої кислоти називаються силікатами. Їх склад зазвичай зображують формулою у вигляді сполук оксидів елементів. Наприклад, силікат кальцію CaSiO 3 можна висловити так: СаO SiO 2.
Силікати зазвичай нерозчинні у воді. Виняток становлять силікати натрію і калію, одержувані сплавом SiO 2 з відповідними гідроокисами або карбонатами, наприклад:
SiO 2 Na 2 CO 3 = CO 2 Na 2 SiO 3
Водні розчини цих солей називаються «рідким склом». В результаті гідролізу «рідке скло» має сильнолужну реакцію. « Рідке скло»Застосовують в якості сполучного при виготовленні кислототривких бетонів, а також для виготовлення замазок, конторського клею. Їм просочують тканини, дерево і папір для додання їм вогнестійкості і водонепроникності.
Земна кора складається з оксиду кремнію (IV) і різних силікатів. Природні силікати мають складний склад і будова. наприклад:
Польовий шпат K 2 О Аl 2 O 3 6SiO 2 слюда K 2 О 3Аl 2 О 3 6SiO 2 2Н 2 Про азбест 3MgO 2SiO 2 2Н 2 Про каолинит Аl 2 O 3 2SiO 2 2Н 2 Про
Силікати, що містять в своєму складі оксид алюмінію, називаються алюмосиликатами. У природі найбільш поширені саме вони, наприклад польові шпати, а також суміші различ-
Них силікатів. Так, гірські породи - граніти і гнейси - складаються з кристалів кварцу, польового шпату і слюди.
Гірські породи і мінерали на поверхні землі під дією температури, а потім і вуглекислого газу вивітрюються, тобто повільно руйнуються.
K 2 О Аl 2 О 3 SiO 2 2Н 2 O СО2 Аl 2 O 3 2SiO 2 2Н 2 Про К 2 СО 3 4SiO 2
Основним продуктом руйнування є мінерал каолініт - головна складова частина білої глини. В результаті вивітрювання гірських порід утворилися поклади глини, піску і солей.
Властивості силікатів бувають досить різні в залежності від їх складу і будови. Часто силікати утворюють прозорі і дуже красиво забарвлені кристали; деякі з них - дорогоцінні камені, використовувані в ювелірній справі (гранат, топаз, смарагд і ін.). Щільність силікатів зазвичай коливається від 2 до 4 г / см 3. Твердість іноді дуже невелика (наприклад, у тальку), але буває досить значною (наприклад, у циркону ZrSiO 4). При нагріванні силікатів вони або плавляться, або розкладаються в твердому стані. Температури плавлення коливаються від 750 до 2000 ° С, а іноді бувають і вище.
З штучних силікатів найбільше значення мають скло, цемент і кераміка.
Склад звичайного віконного скла приблизно виражають формулою Na 2 O СаО 6SiO 2. Скло отримують сплавом в спеціальних печах суміші соди Na 2 CO 3, вапняку СаСО3 і білого піску SiO 2.
SiO 2 Na 2 CO 3 = Na 2 SiO 3 CO 2
SiO 2 CaCO 3 = CaSiO 3 CO 2
Na 2 SiO 3 CaSiO 3 4SiO 2 = Na 2 O CaO 6SiO 2
Для отримання спеціального скла змінюють склад вихідної суміші. Замінюючи соду Na 2 CO 3 поташом K 2 СО 3, отримують тугоплавкое скло (для хімічного посуду). Замінюючи крейда CaCO 3 оксидом свинцю (II) PbO, а соду поташом, отримують кришталеве скло. Добавки оксидів металів до вихідної суміші додають склу різне забарвлення: оксид хрому (III) Cr 2 O 3 - зелену, оксид кобальту (II) СоО - синю, оксид марганцю (IV) MnO 2 - червонувато-ліловий і т.д.
Скло при підвищенні температури поступово розм'якшуються і переходять в рідкий стан. Зворотний процес здійснюється поступово - скляна маса загусає в міру остигання. На цій властивості скла засновано формування з нього
Різних виробів. За допомогою машин зі скляної маси витягають листове скло.
цемент
Звичайний силікатний цемент, або портландцемент, являє собою зеленувато-сірий порошок, який при змішуванні з водою твердне на повітрі (або в воді) в каменеподібним масу. Зазвичай його отримують випаленням (1400-1600 ° С) до спікання сировинної суміші, що складається з вапняку і глини.
З суміші цементу, води і заповнювачів (пісок, гравій, щебінь, шлак) після затвердіння отримують штучний камінь - бетон. Бетон зі сталевою арматурою називається залізобетоном. Бетони, в яких в якості в'яжучого використовуються органічні полімери або полімери спільно з цементом, називаються пластбетони.
кераміка
Керамікою називають матеріали і різні вироби, що виробляються з природних глин і їх сумішей з мінеральними добавками, а також оксидів і інших неорганічних сполук, шляхом формування, випалу і сушіння. Це цегла, облицювальні плитки, черепиця, труби, глиняний посуд, фарфорові та фаянсові вироби.
Виробництво скла, цементу і кераміки відноситься до силікатної промисловості, переробної природні сполуки кремнію.
Людство познайомилося з кремнієм ще в давнину. Саме з цієї речовини первісні люди робили свої знаряддя праці. А набагато пізніше саме на основі кремнію люди зробили скло. Незважаючи на те, що з'єднання кремнію відомі дуже давно, чистий кремній був отриманий порівняно недавно. Великий вчений Берцеліус в 1823 році зміг отримати чистий аморфний кремній, а в 1854 році А. Сент Клер Девіль отримав кристалічний кремній. Назва елемента в перекладі означає "твердий камінь", що цілком правильно характеризує його фізичні властивості.
У природі кремній не зустрічається в чистому вигляді, частіше за все він представлений оксидом SiO 2, мінералами або солями кремнієвої кислоти.
Особливе значення має мінерали на основі кремнію. Силіциуму - основа таких мінералів як кремінь, азбест, отоклаз, польовий шпат, кварц і кришталь. Дані мінерали утворюють цілі гори, а численний пісок не що інше, як подрібнений кварц з численними домішками. У тварин і рослинах кремній не поширений. Його кількість в тканинах живих істот невелика, а з віком його кількість зменшується.
Кремній одержують відновленням його оксиду при високих температурах:
SiO 2 + С = Si + 2CO
3SiO 2 + 4Al = 3Si + 2Al 2 O 3
Також кремній можна отримати при термічному розкладанні силана (водневе з'єднання кремнію)
Кремній - типовий неметалл, йому притаманні всі типові властивості його групи.
1) Взаємодія з киснем
Отриманий оксид кремнію 4 інертний за своїми властивостями, важко вступає в реакції, але активно реагує з плавиковою кислотою:
4HF + SiO 2 = SiF 4 + 2H 2 O
2) Взаємодія з галогенами
При кімнатній температурі кремній реагує тільки з фтором, при нагріванні - з хлором.
Si + 2Cl 2 = SiCl 4
3) Взаємодія з вуглецем
Si + C = Si +4 C -4
В результаті цієї реакції виходить речовина карборунд. Воно володіє унікальними фізичними властивостями: його міцність подібна міцності алмазу.
У Карборунд вуглець проявляє негативну ступінь окислення, а кремній - позитивну, що обумовлено положенням цих елементів у періодичній таблиці.

4) Взаємодія з металами
Si + 2Mg = Mg 2 Si
Si + 4Na = Na 4 Si
Отримані речовини називають силіцидом. При дії на них сильних кислот виділяється газ силан, який за своїми хімічними властивостями сильно нагадує алкани, але набагато менш стійкий через велику довжину зв'язку.
5) Відновлення оксидів
при підвищеній температурі кремній здатний відновити багато метали з їх оксидів.
2CuO + Si = SiO 2 + 2Cu
6) Взаємодія з лугами
При підвищеній температурі кремній вступає в реакцію з розчинами лугів
Si + 2NaOH + H 2 O = Na 2 SiO 3 + 2H 2 (метаксілат натрію)
Si + 4NaOH = Na 4 SiO 3 + 2H 2 (ортоксілат натрію)
властивості
14 Si.|
атомна маса |
кларк, ат.% (Распространненость в природі) |
||
|
Електронна конфігурація * |
Агрегатний стан |
тверда речовина |
|
|
темно-сірий блискучий |
|||
|
енергія іонізації
|
|||
|
Відносна електро- негативність |
щільність |
||
|
Можливі ступені окислення |
Стандартний електродний потенціал |
* Наведено конфігурація зовнішніх електронних рівнів атома елемента. Конфігурація інших електронних рівнів збігається з такою для благородного газу, завершального попередній період і зазначеного в дужках.
Знаходження в природі.
Кремній після кисню - найпоширеніший елемент у земній корі. На відміну від вуглецю у вільному стані кремній в природі не зустрічається. Найбільш поширеними його сполуками є оксид кремнію (IV) SiO 2 і солі кремнієвих кислот - силікати. Вони утворюють оболонку земної кори. З'єднання кремнію містяться в організмах рослин і тварин.Природні силікати мають складний склад і будова. Ось склад деяких природних силікатів: польовий шпат До
2 Про × Аl 2 O 3 × 6SiO 2, азбест 3 Mg Про × 2SiO 2 × 2H 2 O, cлюду К2О × 3 А l 2 O 3 × 6SiO 2 × 2H 2 O,каолинит 3 А l 2 O 3 × 2SiO 2 × 2H 2 O.Силікати, що містять в своєму складі також оксид алюмінію, називаються алюмосиликатами. З названих вище силікатів алюмосиликатами є польовий шпат, каолініт і слюда. У природі найбільш поширені саме алюмосилікати, наприклад польові шпати. Поширені також суміші різних силікатів. Так, гірські породи - граніти і гнейси - складаються з кристаликів кварцу, польового шпату і слюди
.Основним продуктом руйнування є мінерал каолініт - головна складова частина білої глини. В результаті вивітрювання гірських порід утворилися поклади глини, піску і солей.
Отримання. У промисловості кремній отримують відновленням
SiO 2 коксом в електричних печах:У лабораторії в якості відновників використовують магній або алюміній:
Найбільш чистий кремній отримують відновленням тетрахлориду кремнію парами цинку:
Застосування.
Кремній використовують в якості напівпровідника. З нього виготовляють, так звані, сонячні батареї, що перетворюють світлову енергію в електричну (харчування радіоустановок космічних кораблів). Кремній використовують в металургії для отримання кременистих сталей, що володіють високою жаростійкістю і кислотоупорностью.Фізичні властивості. Кристалічний кремній - речовина темно-сірого кольору зі сталевим блиском. Структура кремнію аналогічна структурі алмазу. У його кристалі кожен атом оточений Тетраедрично чотирма іншими і пов'язаний з ними ковалентним зв'язком, яка значно слабкіше, ніж між атомами вуглецю в алмазі. У кристалі кремнію навіть при звичайних умовах частина ковалентних зв'язків руйнується. Тому в ньому є вільні електрони, які обумовлюють невелику електричну провідність. При висвітленні і нагріванні збільшується число об'єктів, що руйнуються зв'язків, а значить, збільшується число вільних електронів і зростає електрична провідність. Так слід пояснювати напівпровідникові властивості кремнію.
Кремній дуже крихкий, його щільність 2,33 г / см 3 . Як і вугілля, відноситься до тугоплавким речовин.
Кремній складається з трьох стабільних ізотопів: 28 14 Si (92,27%), 29 14 Si (4,68%) і 30 14 Si (3,05%).
Хімічні властивості.
За хімічними властивостями кремній, як і вуглець, є неметаллом, але його неметаллічность виражена слабше, так як він має більший атомний радіус. Оскільки у атомів кремнію на зовнішньому енергетичному рівні знаходиться 4 електрона, то для кремнію характерна ступінь окислення як -4, так і +4 (відомо з'єднання кремнію, де його ступінь окислення дорівнює +2).Кремній при звичайних умовах досить інертний, що слід пояснити міцністю його кристалічної решітки. Безпосередньо він взаємодіє тільки з фтором:
![]()
Кислоти (крім суміші плавикової
HF і азотної HNO 3 ) На кремній не діють. Однак він розчиняється в гідроксиди лужних металів, утворюючи силікат і водень:З двох аллотропних модифікацій кремнію - кристалічної і аморфної - хімічно більш активним є аморфний кремній. Він реагує з киснем при нагріванні, утворюючи
SiO 2:![]()
а також з усіма галогенами, наприклад:
![]()
При високій температурі кремній з'єднується з вуглецем, утворюючи карборунд
SiC:![]()
Карборунд має алмазоподобную кристалічну решітку, в якій кожен атом кремнію оточений чотирма атомами вуглецю і навпаки, а ковалентні зв'язки дуже міцні, як в алмазі. Тому по твердості він близький до алмазу. З карбіду кремнію виготовляють точильні камені та шліфувальні круги.
Силіцид магнію. У реакціях з активними металами, що протікають з утворенням силіцидів, кремній виступає в ролі окислювача:
![]()
При високих температурах кремній відновлює багато метали з їх оксидів.
Сілан. При дії на силіциди соляної кислоти отримують найпростіше водневе з'єднання кремнію силан
SiH 4: - отруйний газ з неприємним запахом, самозаймається на повітрі:оксид кремнію
(IV).Оксид кремнію (IV) називають також кремнеземом. Це тверде тугоплавка речовина(Температура плавлення 1700 ° С), широко поширене в природі в двохвидах: 1) кристалічний кремнезем - у вигляді мінералу кварцу і його різновидів (гірський кришталь, халцедон, агат, яшма, кремінь); кварц становить основу кварцових пісків, широко використовуваних в будівництві і в силікатної промисловості; 2) аморфний кремнезем - у вигляді мінералу опала складу SiO 2 × п H 2 O; землистими формами аморфного кремнезему є діатоміт, трепел (інфузорна земля); прикладом штучного аморфного безводного кремнезему може служити силікагель, який виходить з метасилікат натрію:
Силікагель має розвинену поверхню, а тому добре адсорбує вологу.
При 1710 ° кварц плавиться. При швидкому охолодженні розплавленої маси
утворюється кварцове скло. Воно має дуже малий коефіцієнт розширення, завдяки чому розпечене кварцове скло не тріскається при швидкому охолодженні водою. З кварцового скла виготовляють лабораторний посуд і прилади для наукових досліджень.Найпростіша формула оксиду кремнію (IV) SO 2 аналогічна формулі оксиду вуглецю (IV) ЗO 2 . Тим часом фізичні властивості їх різко відрізняються (SiO 2 - тверда речовина, CO 2 - газ). Ця різниця пояснюється будовою кристалічних решіток. С0 2 кристалізується в молекулярної решітці, SiO 2 - в атомній. структуруSiO 2 в площинному зображенні можна змалювати таку картину: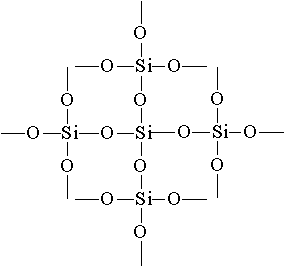
Координаційне число атома вуглецю в твердому З
O 2 дорівнює 2, а кремнію в SiO 2 дорівнює 4. Кожен атом кремнію укладений в тетраедр з 4 атомів кисню. При цьому атом кремнію знаходиться в центрі, а по вершинах тетраедра розташовані атоми кисню. Весь шматок кремнезему можна розглядати як кристал, формула якого (SiO 2) n. Така будова оксиду кремнію (IV) обумовлює його високу твердість і тугоплавкость.За хімічними властивостями оксид кремнію (IV)
SiO 2 відноситься до кислотних оксидів. При сплаві його з твердими лугами, основними оксидами і карбонатами утворюються солі кремнієвої кислоти: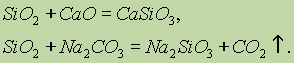
З оксидом кремнію (IV) взаємодіє тільки плавикова кислота:
За допомогою цієї реакції виробляється травлення скла.
У воді оксид кремнію (IV) розчиняється і з нею хімічно не взаємодіє. Тому кремнієву кислоту отримують непрямим шляхом, діючи кислотою на розчин силікату калію або натрію:
При цьому кремнієва кислота
(В залежності від концентрації вихідних розчинів солі і кислоти) може бути отримана як у вигляді студнеобразной маси, що містить воду, так і у вигляді колоїдного розчину (золю).Кремнієві кислоти.
SiO 2 є ангідридом ряду кремнієвих кислот, склад яких можна виразити загальною формулою xSiO 2 × yH 2 O, де х і у - цілі числа: = 1, у = 1: SiO 2 × H 2 O, т. е. H 2 SiO 3 - метакремнієва кислота;2) х = 1, у = 2: SiO 2 × 2H 2 O, т. е. H 4 SiO 4 - ортокремнієвої кислота;
х = 2, у = 1: 2SiO 2 × H 2 O, т. е. H 2 Si 2 O 5 - двуметакремніевая кислота. Кремнієва кислота побудована з тетраедричних структурних ланок (в кожному такому ланці атом кремнію знаходиться в центрі тетраедра, а по вершинах розташовані атоми кисню). Структурні ланки, об'єднуючись в ланцюзі, утворюють більш стійкі полікремнієві кислоти:
Склад такого з'єднання можна виразити формулою
(H 2 SiO 3) n. Однак зазвичай кремнієву кислоту зображують формулою H 2 SiO 3. H 2 SiO 3 - кислота дуже слабка, в воді мало розчинна. При нагріванні легко розпадається аналогічно вугільної кислоти:Все кремнієві кислоти дуже слабкі (слабше вугільної).
Силікати.
Солі всіх кремнієвих кислот називають силікатами, хоча, як правило, в навчальній літературі під силикатами увазі солі метакремнієвої кислоти. Їх склад зазвичай зображують формулою у вигляді сполук оксидів елементів. Наприклад, силікат кальцію CaSiO 3 можна висловити так: СаО ×SiO 2.силікати складу
R 2 О × nSiO 2, де R 2 O - оксиди натрію або калію, називаються розчинним склом, а їх концентровані водні розчини - рідким склом. Найбільше значення має натриевое розчинне скло.При стоянні на повітрі розчини силікатів мутніють, так як знаходиться в повітрі оксид вуглецю (IV) витісняє кремнієву кислоту з її солей:
Кремнієва кислота практично нерозчинні в воді - це властивість використовують як якісну реакцію на іон
SiO 3 2 - .Силікати отримують сплавом оксиду кремнію з лугами або карбонатами:
Застосування силікатів.
Найбільш широко використовуються силікати натрію і калію. Концентровані розчини цих солей називають рідким склом; вони мають сильнолужну реакцію внаслідок гідролізу. Рідке скло використовують при виготовленні клею і водонепроникних тканин. Рідке скло застосовується в якості сполучного при виготовленні кислототривких бетонів, а також для виготовлення замазок, конторського клею. Їм просочують тканини, дерево і папір для додання їм вогнестійкості і водонепроникності.Copyright © 2005-2013 Xenoid v2.0
Використання матеріалів сайту можливе за умови вказівки активного посилання
| Статті по темі: | |
|
Чому відбувається різке підвищення артеріального тиску?
Найпомітніші ознаки високого тиску - це головний біль, ... Вага стоїть на місці - що робити для схуднення, як змусити його знижуватися
Під час тривалого схуднення майже все стикаються з проблемою ... Способи заробітку біткоіни на автоматі
ВконтактеОднокласснікі Сьогодні біткоіни (гроші електронної платіжної ... | |